导读
自噬是一个进化上保守的分解代谢过程,能通过降解细胞质中的物质来维持细胞稳态,清除损伤的细胞器和错误折叠的蛋白质,从而防止癌症、神经退行性疾病等病症的发生。
自噬的过程需精细调控以避免不必要的细胞质分解。多种营养应答因子通过转录和翻译层面调控自噬基因的表达,调节自噬过程。Atg1/ULK1是启动自噬的关键蛋白,它在饥饿条件下上调。但在氮源匮乏时,全局翻译水平下调,ATG1转录本如何逃避抑制仍不清楚。
RNA结合蛋白(RBPs)通过与ATG1 mRNA相互作用,调节其稳定性和翻译,从而调控自噬。研究表明,ATG1 mRNA的调控网络复杂,可能通过动态的RBP互作组调节Atg1蛋白的表达,进一步调控自噬。
2025年2月24日,美国密西根大学Daniel J. Klionsky团队在Cell Reports上发表了一篇题为“Yeast TIA1 coordinates with Npl3 to promote ATG1 translation during starvation”的论文,分析了在富营养和氮源匮乏条件下,ATG1 5'非翻译区(UTR)和3'UTR的RNA结合蛋白组情况,揭示了与ATG1 mRNA相互作用的蛋白质网络,这一网络调控Atg1蛋白的表达,从而调控自噬过程。


文章索引
【发表日期】2025年2月24日
【IF】9.995
研究结果
一. 体外互作组捕获揭示了多个结合ATG1 mRNA的新伙伴
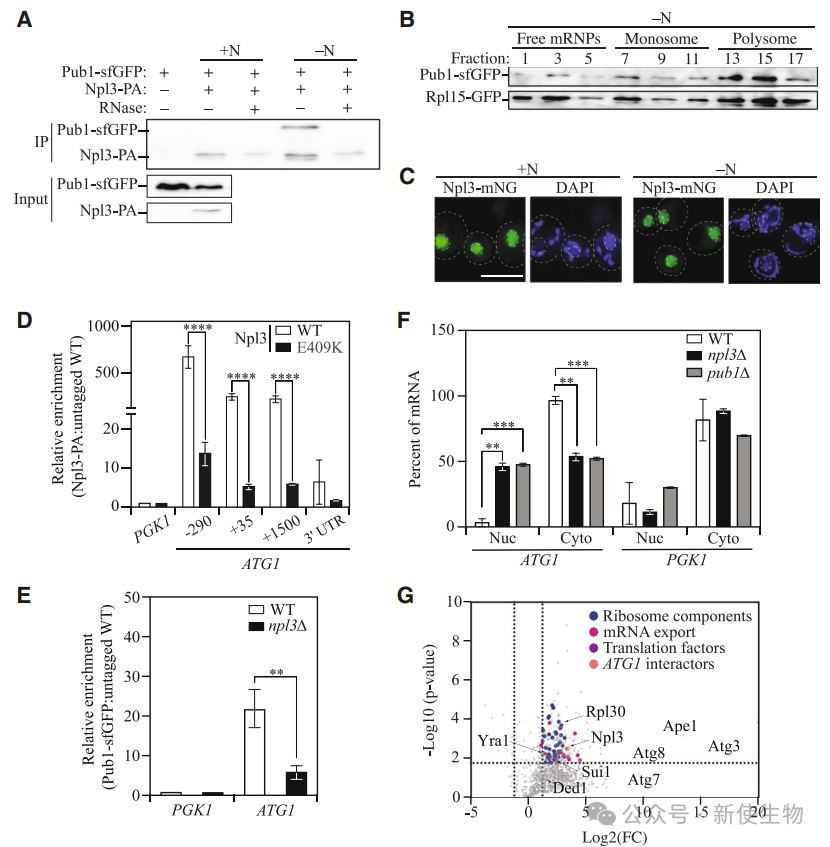
作者通过亲和性分离和蛋白质组学分析识别了13种在氮源匮乏条件下富集的RNA结合蛋白(RBPs)。实验发现,NPL3缺失仅在氮源匮乏时抑制Atg1蛋白上调,表明Npl3在氮源缺乏时调节Atg1表达。
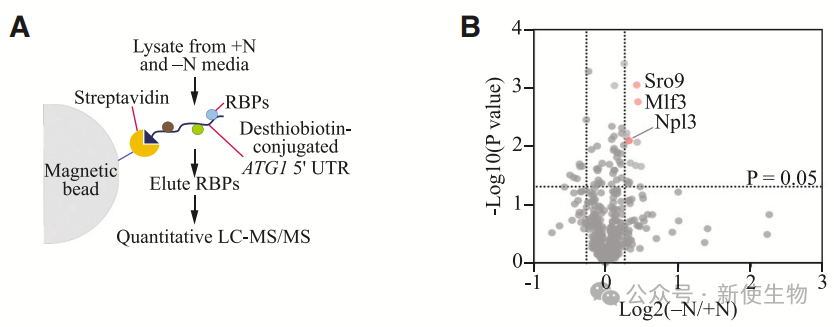
二. Npl3是Atg1蛋白表达和自噬的新型调控因子
Npl3结合ATG1 5' UTR,在氮饥饿时上调Atg1蛋白表达并促进自噬。其调控作用发生在转录后/翻译水平,且缺失Npl3降低自噬活性和细胞存活率。
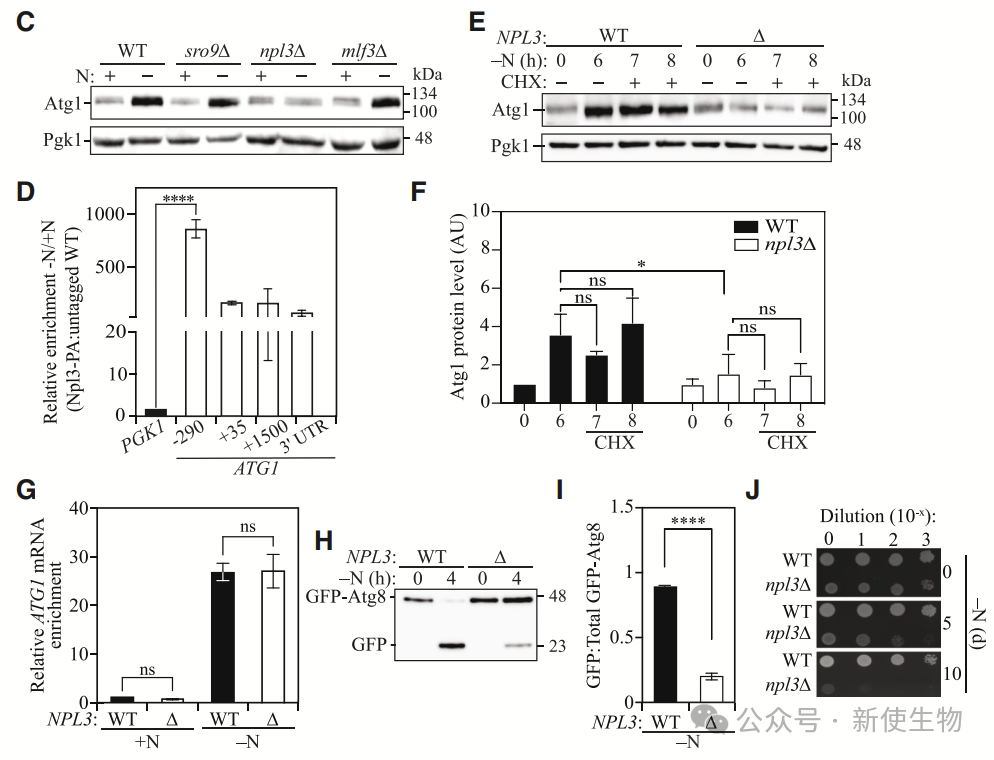
三. Npl3通过RRM依赖机制调控Atg1表达和自噬
Polysome profiling多聚核糖体分析发现,Npl3缺失导致ATG1 mRNA在核内积累,翻译效率降低,从而导致Atg1蛋白水平下降。Npl3通过其RRM2序列直接与ATG1转录本的5' UTR结合,促进ATG1的输出和核糖体招募。
总体而言,尤其在氮饥饿条件下,Npl3通过促进ATG1 mRNA的输出和翻译,调节Atg1蛋白的表达,

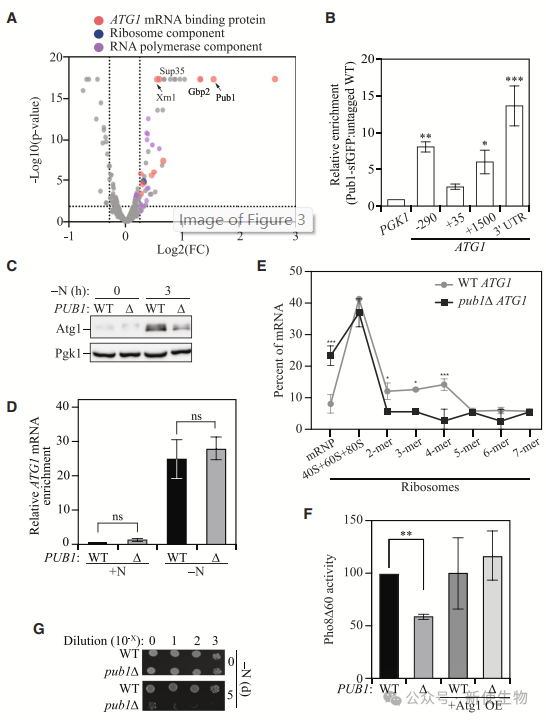
四. Pub1促进ATG1 mRNA的翻译和自噬
Pub1通过与ATG1 3' UTR结合,调节Atg1蛋白表达。删除pub1会降低ATG1翻译,影响自噬活性和细胞存活,但过表达ATG1可部分恢复自噬缺陷。
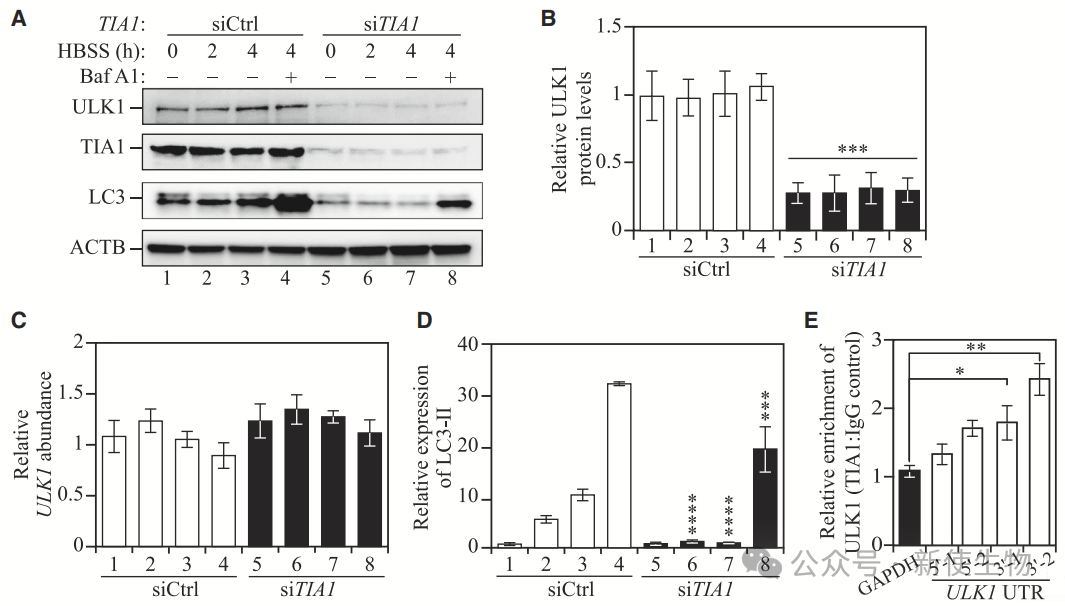
五. TIA1促进ULK1表达和自噬
为了探究Pub1调控Atg1表达的保守性,作者研究了TIA1对ULK1蛋白表达和自噬的影响。
结果显示,TIA1敲低减少了ULK1蛋白水平,但不影响其转录水平,提示TIA1通过转录后调控ULK1表达。TIA1还通过与ULK1的3' UTR相互作用,调节自噬过程。
这些结果表明,Pub1和TIA1通过3' UTR调控ATG1和ULK1的表达,具有保守性。
六. Npl3与Pub1协同作用,ATG1 mRNA输出并招募多聚核糖体进行翻译
研究发现,Npl3和Pub1共同调控ATG1 mRNA的转录后表达。Npl3与Pub1在氮饥饿条件下相互作用,Pub1与单核糖体和多聚核糖体结合,直接参与ATG1翻译,而Npl3则起间接作用。
Npl3通过其核定位协助ATG1 mRNA的出口,并与Pub1共同调控翻译。Pub1还通过与mRNA出口蛋白的相互作用,连接核内mRNP加载和细胞质翻译,促进Atg1蛋白合成,支持自噬过程。
总结
本文发现Npl3和Pub1在氮源匮乏条件下与ATG1的5'和3'非翻译区相互作用,协同促进ATG1 mRNA的转运及其与翻译机器的相互作用。此外,在非小细胞肺癌细胞中,TIA1调控ULK1蛋白表达和自噬。这些发现揭示了通过RBP调控Atg1蛋白表达以维持自噬的机制。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
