
在本期Molecular Cell杂志中,重庆医科大学第一附属医院妇产科Ping Yi团队发现了一种由YTHDF2协调的卵巢癌中新型的翻译起始机制,从根本上重塑了大家对其功能多样性和治疗意义的认识,并为克服卵巢癌化疗耐药性提供了一个新的靶点。

YTHDF2是经典的m6A识别蛋白,通常被认为促进mRNA降解。然而,这期文章在卵巢癌中发现YTHDF2的一个全新功能:它与翻译起始因子eIF3F和解旋酶DDX1形成复合物,促进微管相关蛋白(如CKAP2)等m6A修饰mRNA的翻译,从而增强蛋白合成,推动肿瘤进展并引起紫杉醇耐药。
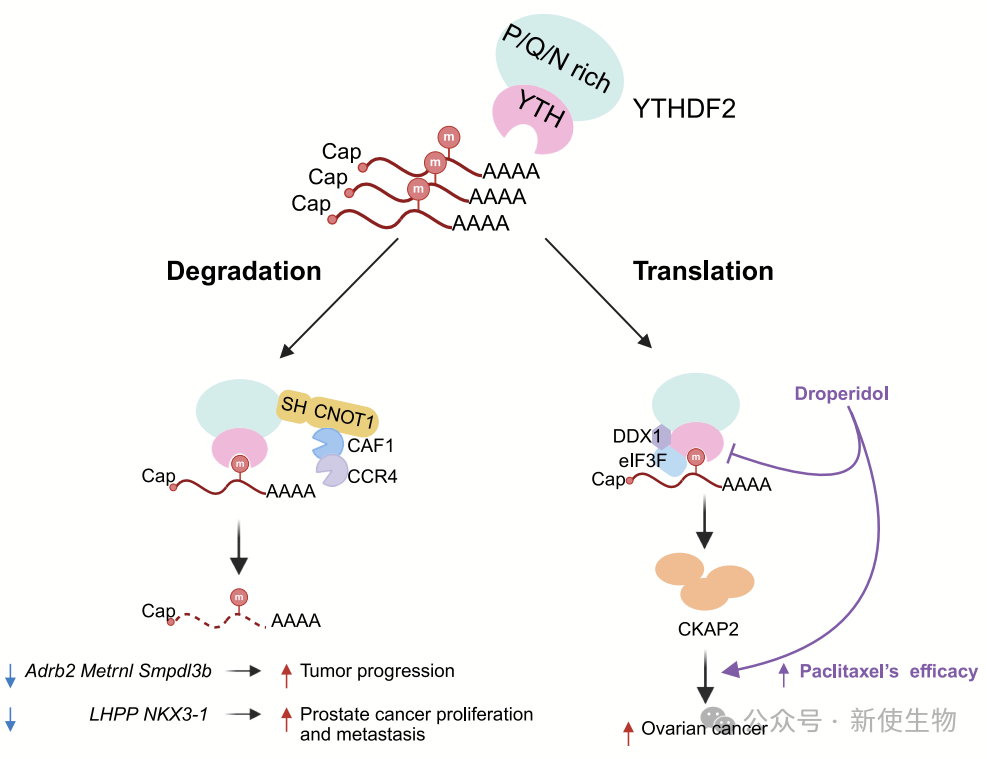
研究结合多组学分析(MeRIP-seq、RIP-seq、Ribo-seq等)和体内外功能实验证实,YTHDF2高表达与卵巢癌分级、分期及不良预后密切相关。其翻译调控功能不依赖传统m6A识别域,也不影响RNA稳定性,提示其在特定癌细胞环境中具有独特机制。
通过筛选,研究者发现了YTHDF2的特异性小分子抑制剂droperidol,能够阻断其与DDX1/eIF3F的互作,抑制蛋白翻译并逆转紫杉醇耐药,展现出良好的治疗前景。
本研究不仅揭示了YTHDF2非降解功能在癌症中的新角色,还为克服卵巢癌化疗耐药提供了潜在靶点。未来需进一步探索其调控机制、时空动态以及与其他YTHDF家族成员的功能分工。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们

