
导读
在所有细胞中,蛋白质在核糖体上合成的过程中就开始折叠成其功能性结构。与在溶液中整个序列都可用于折叠不同,共翻译折叠是矢量性的,即新生肽链从核糖体出口通道中逐步出现,允许在合成完成前进行早期折叠。
核糖体通过施加空间限制、与新生肽链相互作用以及调节新生结构域的动态来协调这一过程。分子伴侣可以辅助蛋白质进一步折叠或再折叠。
由局部翻译速率变化或突变引起的共翻译折叠中断可导致蛋白质错误折叠和相关疾病。然而,由于折叠中间体是瞬时的,且与核糖体的相互作用使结构测定复杂化,共翻译折叠的指导原则和途径仍不清楚。
2025年9月5日,马克斯·普朗克多学科科学研究所Marina V. Rodnina团队在Science Advances上发表了一篇题为“Cotranslational protein folding through non-native structural intermediates”的论文,揭示了共翻译折叠存在一个矢量层次结构。早期中间体通过非天然的疏水相互作用得到稳定,随后才重新排列成接近天然的折叠构象。

文章索引
【标题】Cotranslational protein folding through non-native structural intermediates
【发表期刊】Science Advances
【发表日期】2025年9月5日
【作者及团队】马克斯·普朗克多学科科学研究所Marina V. Rodnina团队
【IF】12.5
研究结果
一、计算模拟预测了由非天然疏水相互作用稳定的早期折叠中间体
通过原子级蒙特卡洛模拟,研究发现在翻译早期阶段(45-64个氨基酸),HemK NTD新生肽链会形成由非天然疏水相互作用(主要由3xH3残基介导)稳定的中间体。
这些非天然相互作用在早期比天然核心相互作用(由4xA残基介导)更占优势,暗示了共翻译折叠存在一种矢量性的层级结构。
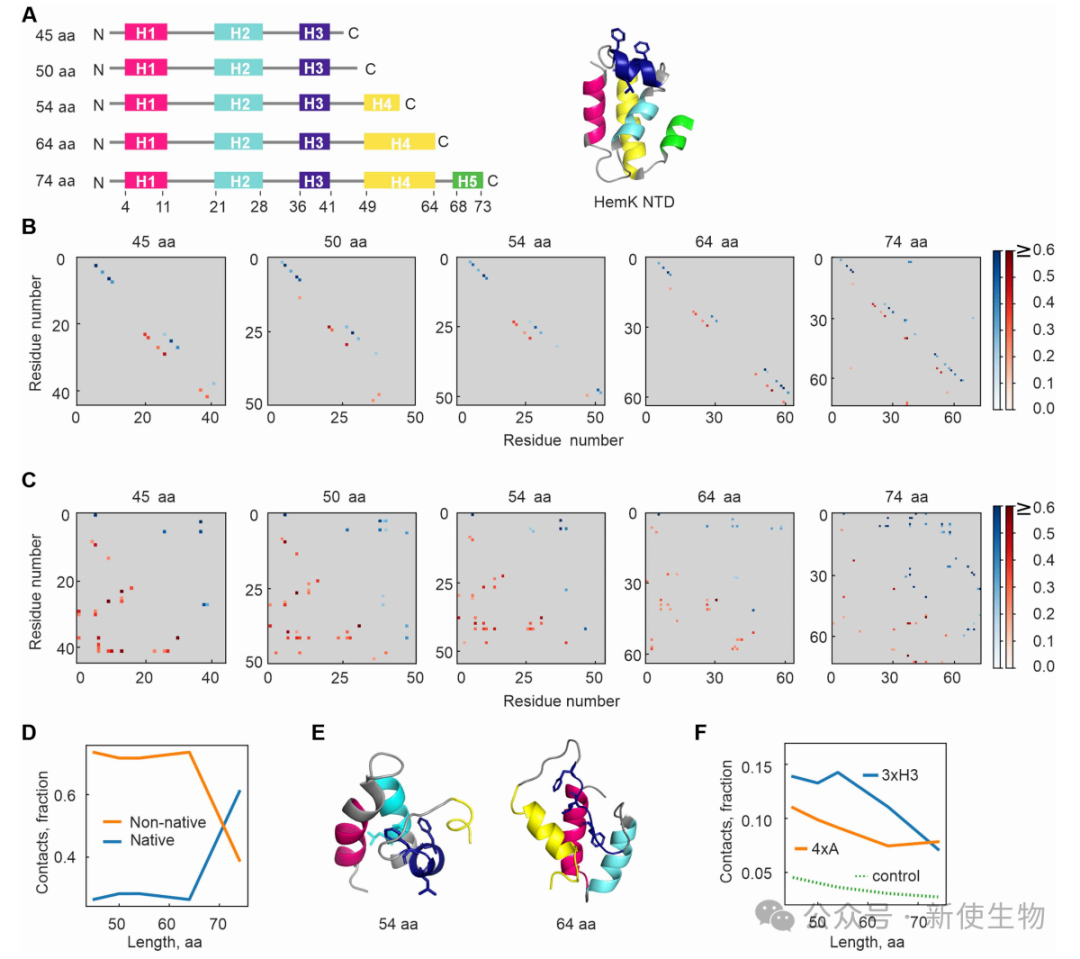
二、实验证实非天然相互作用对共翻译折叠中间体的稳定非常重要
结合荧光相关光谱与光诱导电子转移技术,研究团队制备了不同突变体的核糖体-新生肽链复合物(ribosome-nascent chain complexes, RNCs)进行实验。
作者发现,突变3xH3残基会显著破坏翻译早期中间体的稳定性,而突变形成天然核心的4xA残基主要影响最终全长结构域的稳定性。
这一结果实验性地证实了3xH3残基在稳定早期非天然中间体中的关键作用。
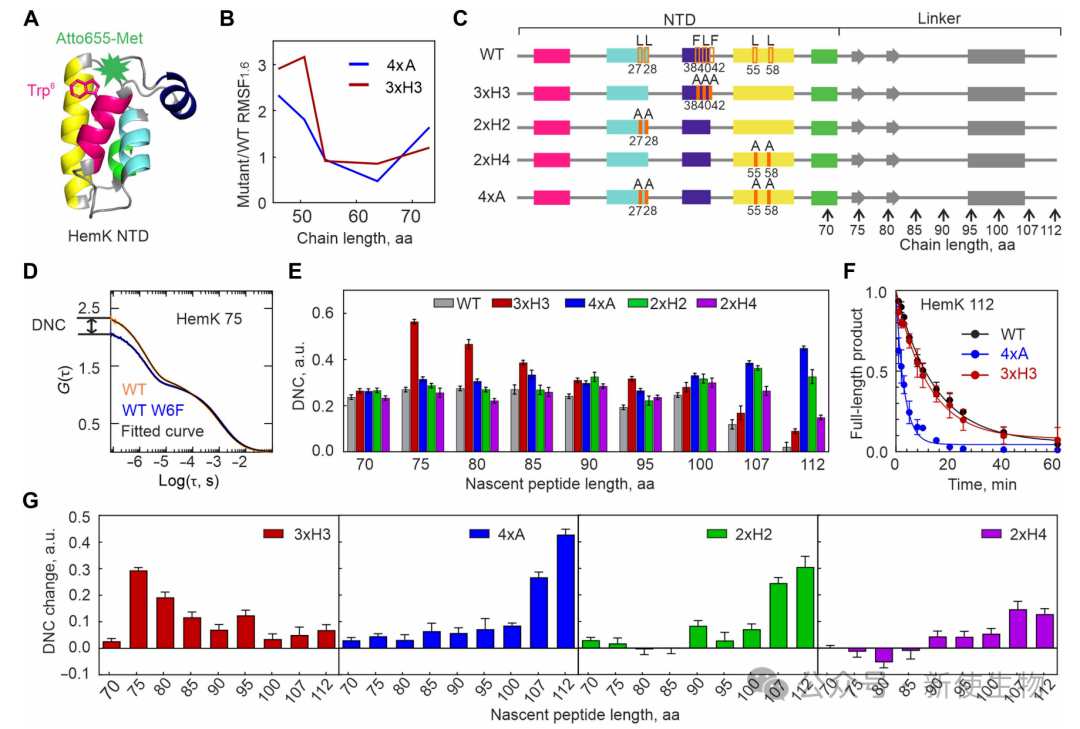
三、破坏非天然相互作用会影响新生肽链的紧凑化和最终折叠
模拟分析表明,3xH3突变体在早期折叠阶段表现出更高的结构波动性和更松散的构象,表明非天然相互作用有助于在核糖体出口通道内形成紧凑的中间体。
相比之下,4xA突变体主要在新生肽链接近全长时才表现出与野生型的差异,此时蛋白质正向天然样状态转变。
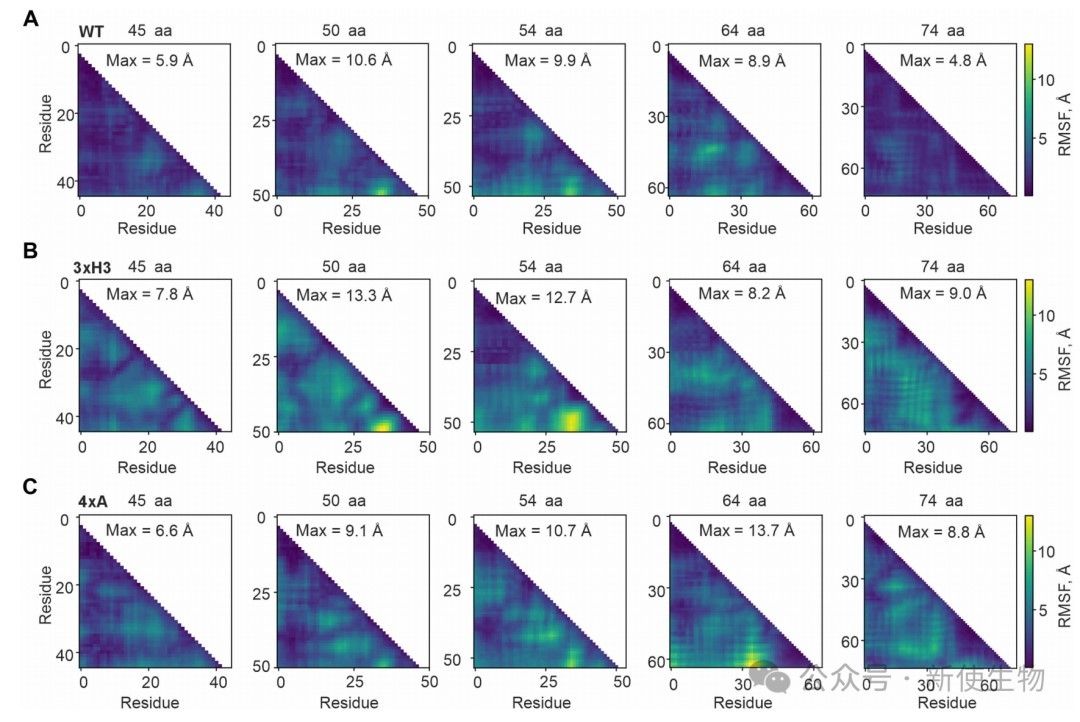
四、实时折叠分析揭示非天然相互作用的破坏导致紧凑但错误的折叠状态
通过停流(stopped-flow)实验实时监测翻译过程中的折叠,研究发现野生型蛋白在合成后会经历一个结构重排过程达到天然样状态,而3xH3突变体则被困在一个紧凑但非天然的错误折叠构象中。
这表明,破坏早期的非天然相互作用会导致蛋白质最终错误折叠。
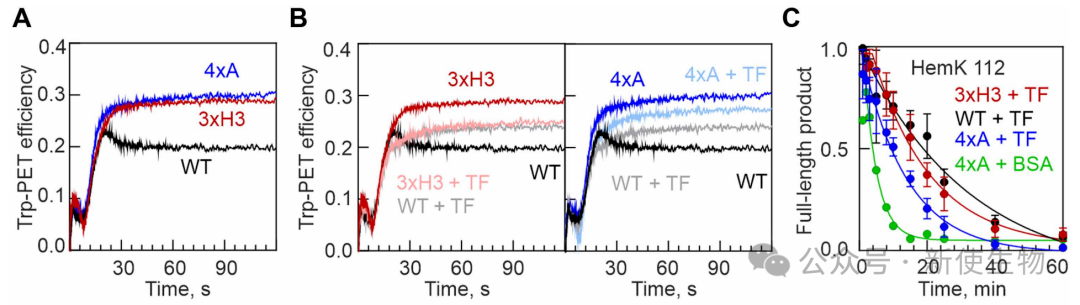
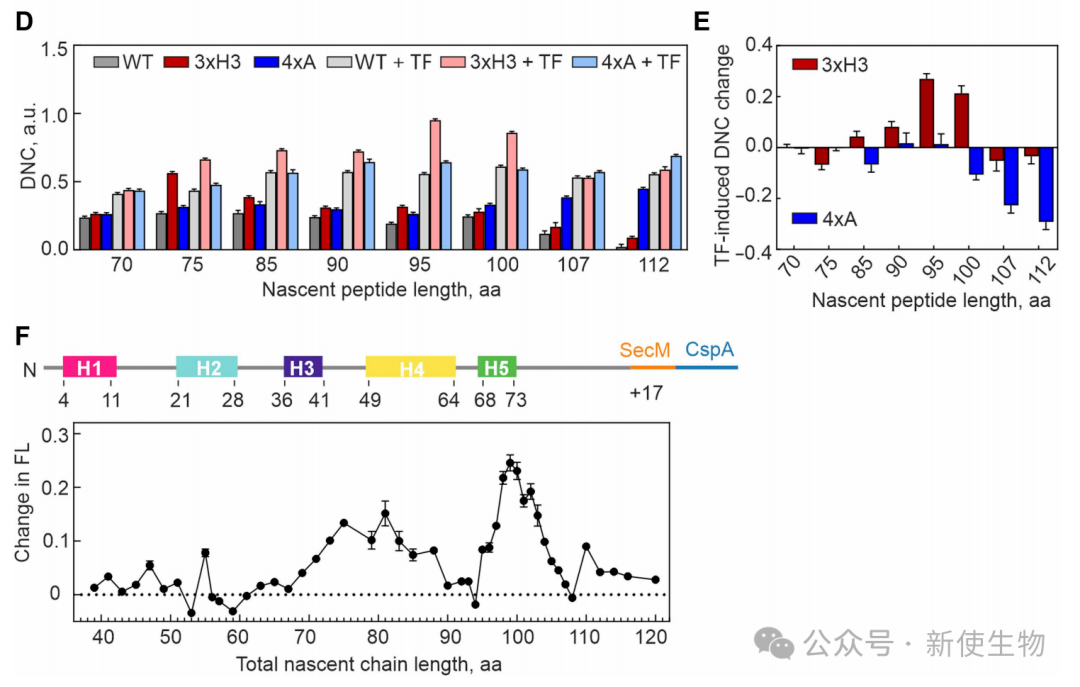
五、分子伴侣触发因子(TF)通过延迟终末折叠来纠正共翻译折叠缺陷
研究表明,分子伴侣TF在翻译早期与新生肽链结合,通过增加其动态性来破坏过早形成的稳定结构,从而延迟最终的折叠。
TF能够有效纠正3xH3突变体造成的折叠缺陷,但无法挽救因天然疏水核心被破坏(4xA突变)而导致的折叠失败,证明了TF通过调节新生链动态来避免错误折叠中间体的形成。
总结
本研究揭示了共翻译蛋白质折叠的一个新机制,即通过一系列由非天然相互作用稳定的中间体,以层级递进的方式进行。研究结果不仅阐明了分子伴侣TF在预防错误折叠中的作用,也为理解翻译节律如何影响蛋白质折叠以及蛋白质设计提供了新的见解和工具。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
