
导读
mRNA疫苗在应对SARS-CoV-2疫情中的巨大成功,证明了合成mRNA作为一种变革性生物医学技术的巨大潜力。该技术的关键特征是在体外转录(IVT)过程中引入修饰核苷,特别是N¹-甲基假尿苷(m1Ψ)。
现有研究表明,m1Ψ能够通过降低天然免疫系统的识别来减少免疫原性,并同时增强蛋白质的表达水平。尽管m1Ψ已被广泛应用于临床治疗,但科学界对其如何直接调控核糖体翻译动力学的机制仍缺乏深入了解。
近期虽有研究指出m1Ψ可能诱发+1位核糖体移码,且在体外实验中表现出对翻译速率的影响,但这些现象在哺乳动物细胞中的具体表现及序列背景依赖性仍不清楚。深入探究m1Ψ对翻译过程的直接影响,对于优化下一代mRNA疗法的设计和评估至关重要。
2026年1月14日,以色列魏茨曼科学研究所Noam Stern-Ginossar团队在Nature上发表了一篇题为“N¹-Methylpseudouridine directly modulates translation dynamics”的论文。研究发现m1Ψ通过增加核糖体密度直接调控合成mRNA的翻译动力学,不仅在特定序列背景下减缓核糖体的延伸速度,还显著促进了翻译起始。

文章索引
【标题】N¹-Methylpseudouridine directly modulates translation dynamics
【发表期刊】Nature
【发表日期】2026年1月14日
【作者及团队】以色列魏茨曼科学研究所Noam Stern-Ginossar团队
【IF】48.5
研究结果
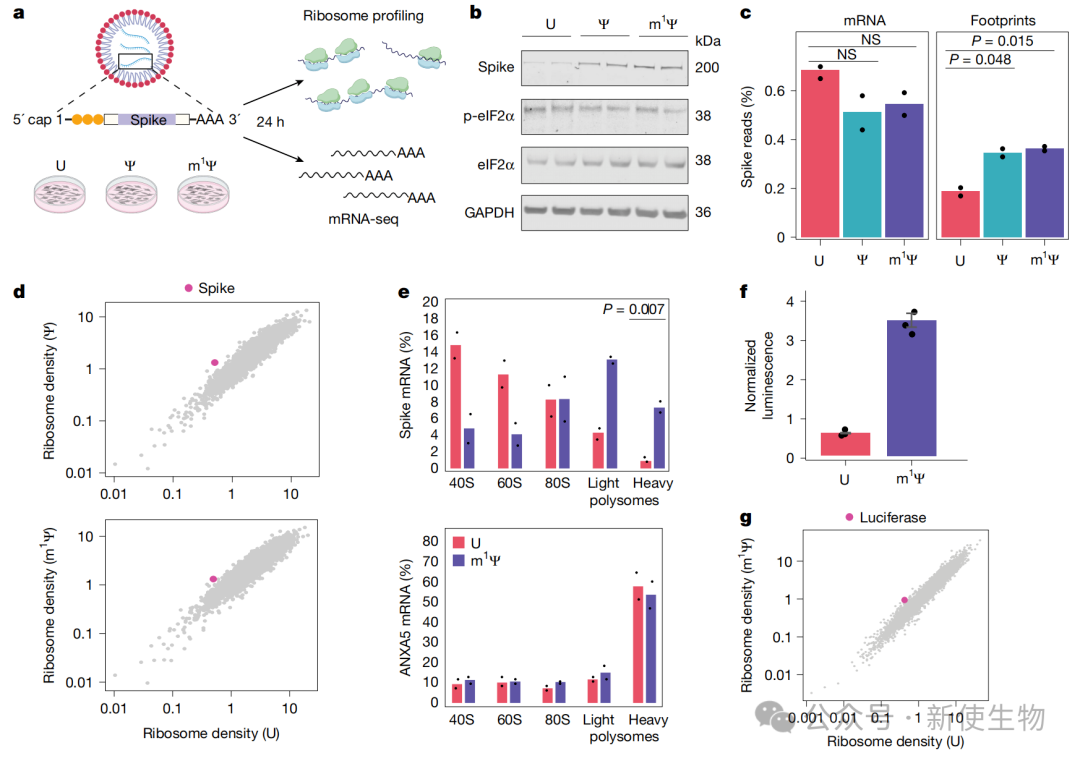
一、修饰后的mRNA具有更高的核糖体负载
研究团队通过对转染了m1Ψ修饰的Spike和荧光素酶mRNA的HEK293T细胞进行Ribo-seq核糖体印迹分析和Polysome profiling多聚核糖体分析显,发现修饰后的mRNA显著增加了核糖体负载,蛋白产量提升3-4倍。
这种增强效果与PKR激活或eIF2α磷酸化无关,证明了m1Ψ对翻译的促进作用是直接且具有修饰特异性的。
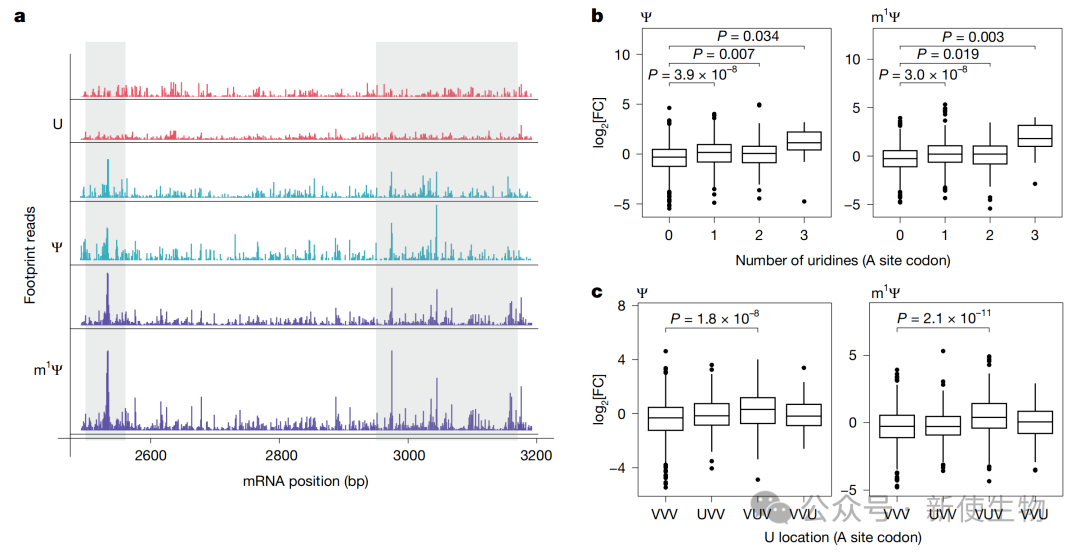
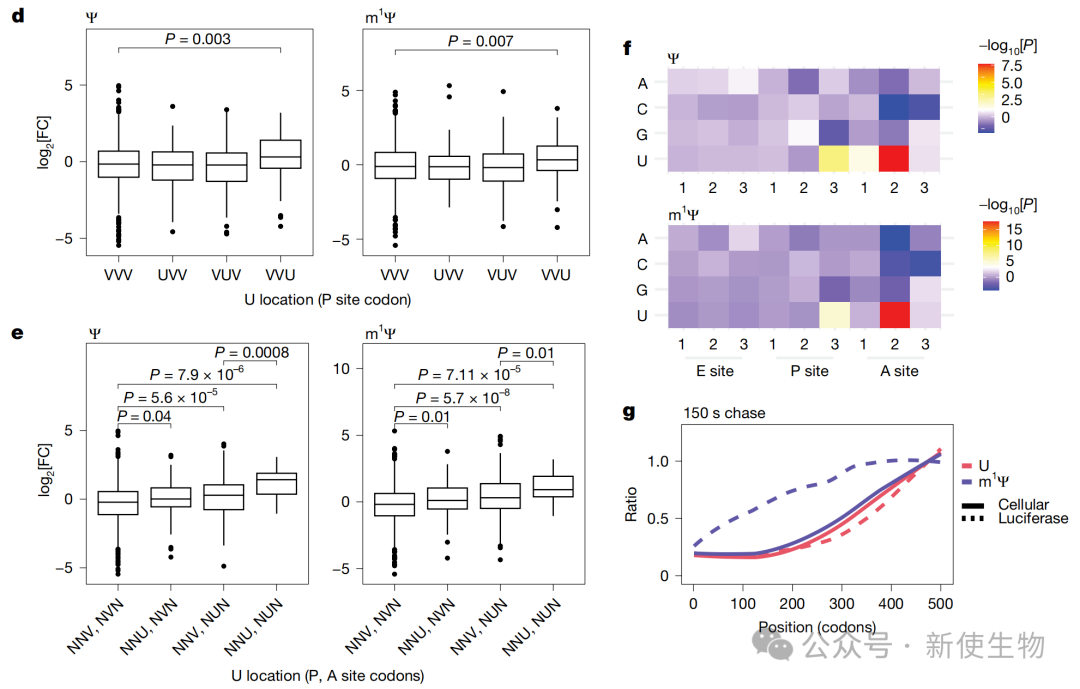
通过亚密码子分辨率的Ribo-seq核糖体印迹分析,研究人员发现m1Ψ修饰在特定序列背景下会导致核糖体暂停,尤其是在P位点密码子为NNU和A位点密码子为NUN的组合处。
Ribosome run-off实验进一步直接证实,与未修饰的mRNA相比,m1Ψ修饰显著降低了核糖体在mRNA上的平均延伸速度。
三、m1Ψ改变解码中心的几何构象
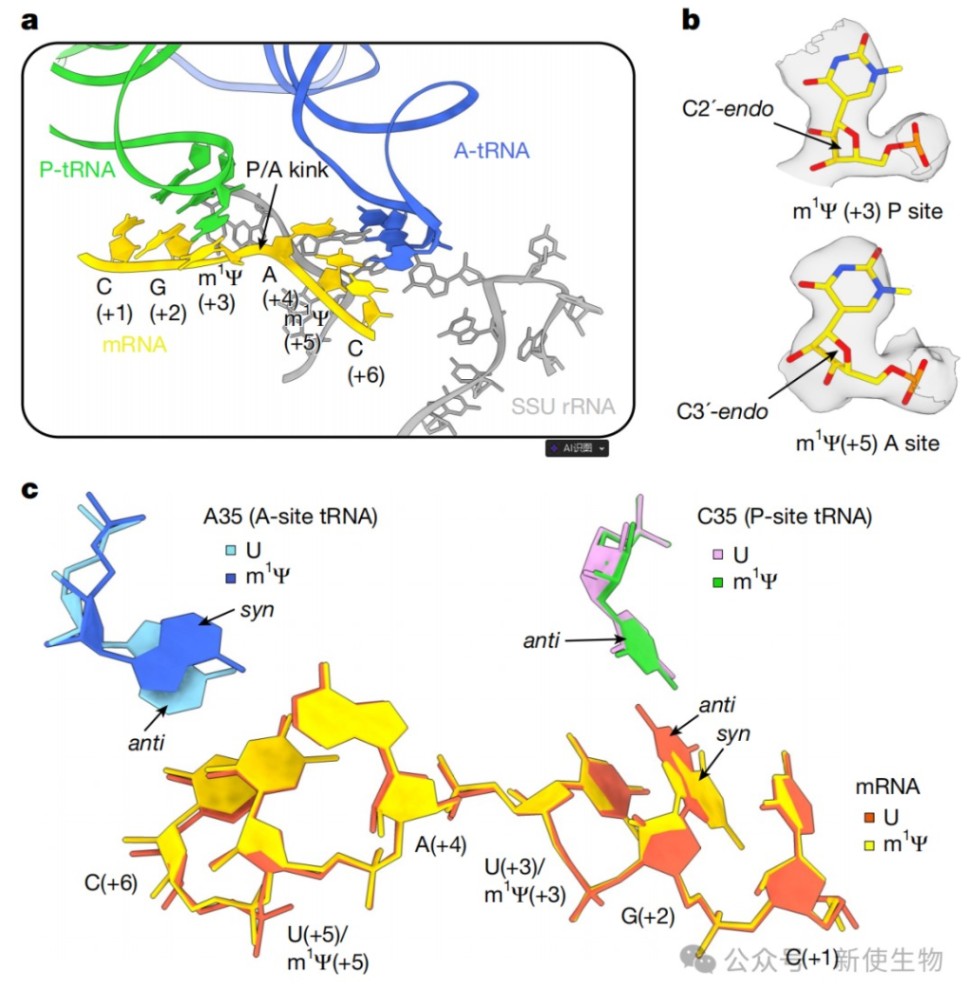
利用冷冻电镜(cryo-EM)技术,研究解析了翻译m1Ψ修饰mRNA的人源80S核糖体高分辨率结构。
结构分析显示,位于P位点的m1Ψ改变了核糖体解码中心的几何构象,包括迫使核糖呈现能量上不利的C2'-endo构象,并促进了非经典的Hoogsteen碱基配对。这种结构变化为m1Ψ减慢翻译延伸提供了机制性解释。
四、修饰mRNA上的翻译起始增强
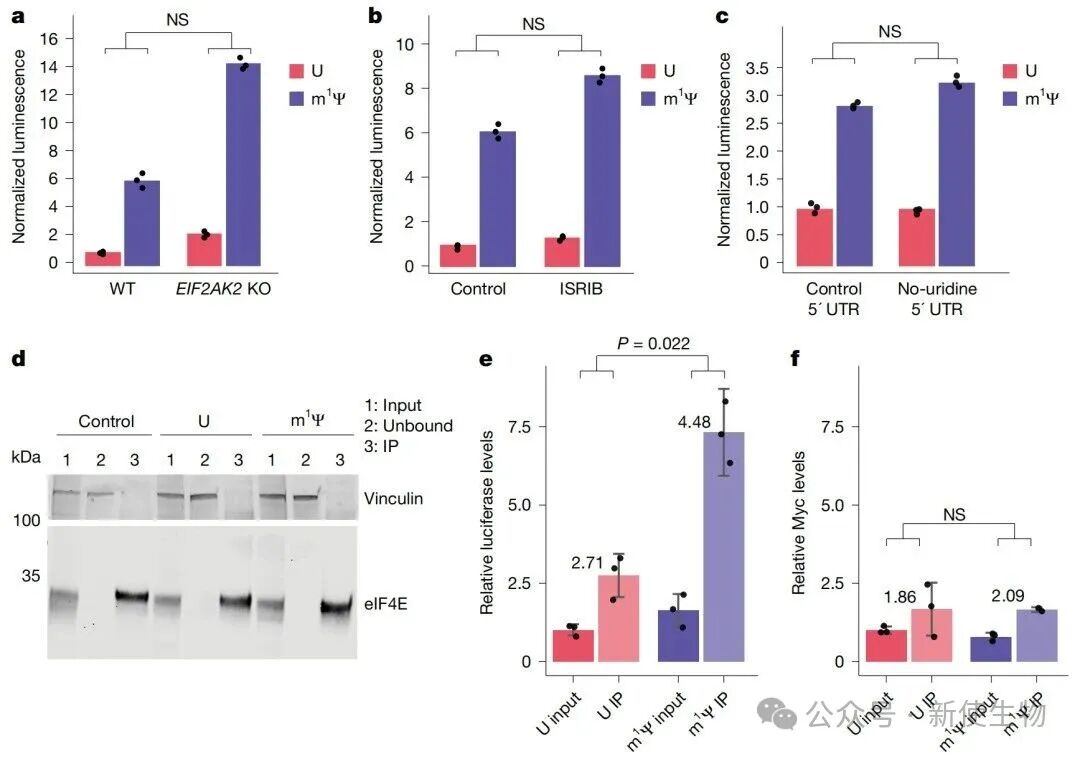
通过在PKR基因敲除细胞中进行实验以及使用eIF2α磷酸化通路抑制剂ISRIB,研究证实m1Ψ对蛋白表达的促进作用不依赖于先天免疫通路的抑制。
进一步的eIF4E RNA免疫沉淀(IP)实验表明,m1Ψ修饰的mRNA能更有效地结合翻译起始因子eIF4E,这表明m1Ψ通过增强翻译起始来提高蛋白产量。
五、翻译延伸减慢的功能性影响
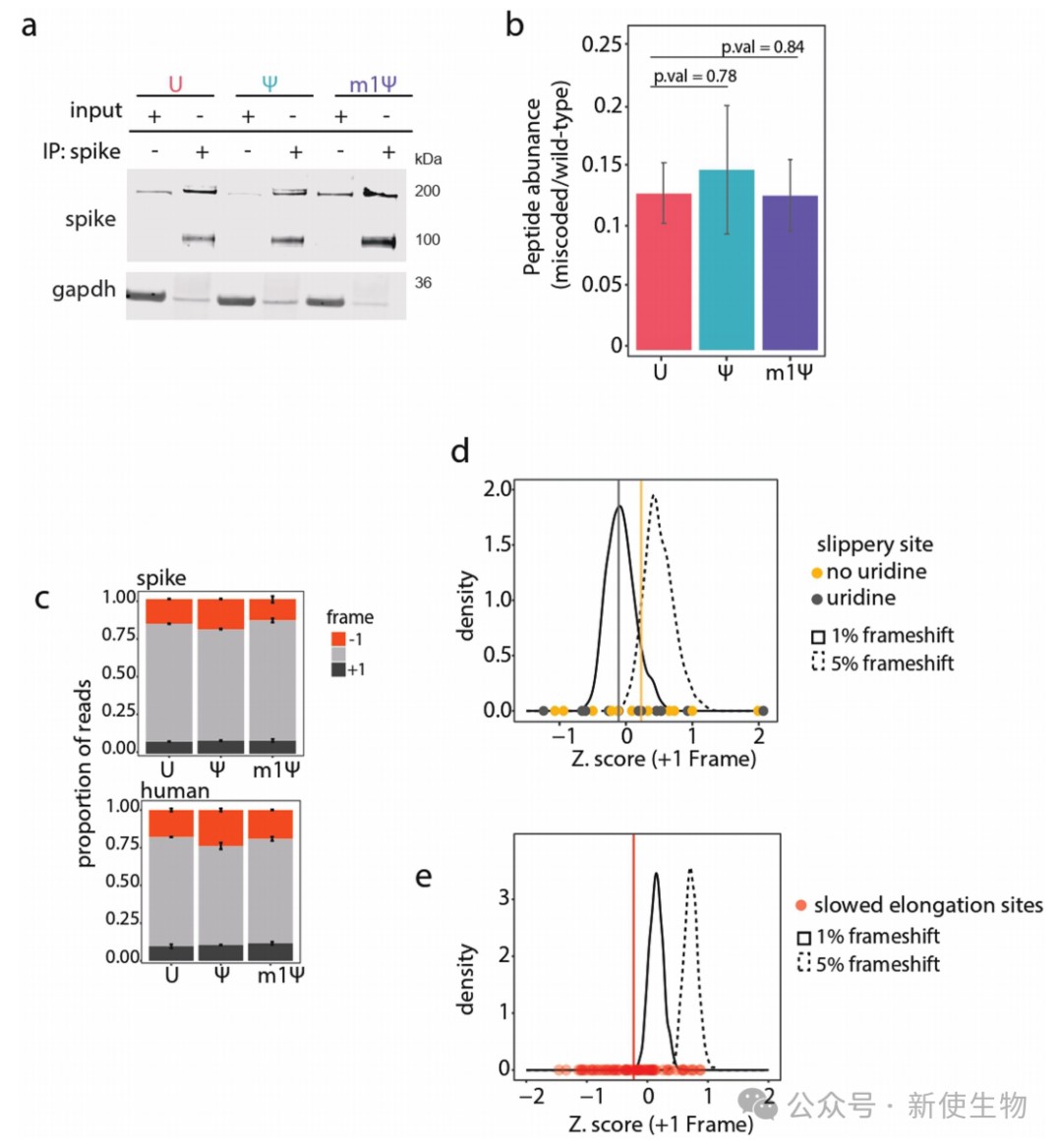
研究人员通过质谱分析和Ribo-seq核糖体印迹分析评估了m1Ψ诱导的延伸减速是否影响翻译保真度和读码框维持。
结果显示,与未修饰的mRNA相比,m1Ψ修饰并未显著增加氨基酸的错掺频率或引起大规模的+1核糖体移码,表明这些并非其主要功能性后果。
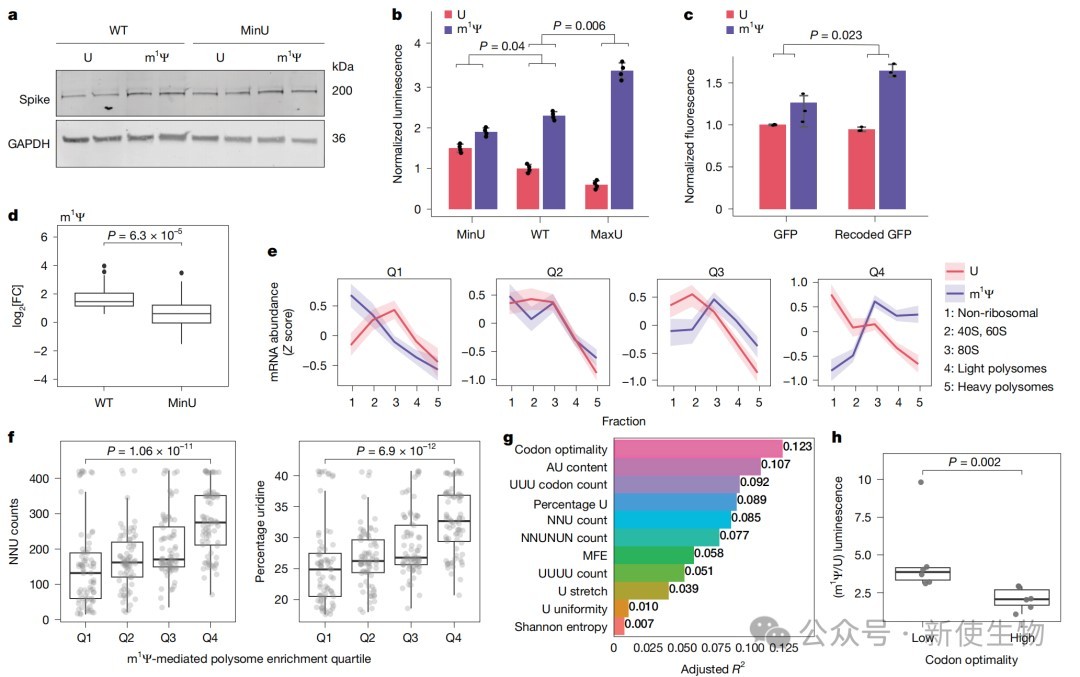
通过对Spike、荧光素酶和GFP基因进行同义突变重编码,以及构建并筛选一个包含305个序列变体的文库,研究发现m1Ψ对蛋白表达的增强效应与编码区的序列特征密切相关。
这种效应在含有较多非优密码子,特别是摆动位(wobble position)为尿苷的密码子的mRNA中最为显著,而在经过高度密码子优化的序列中则效果甚微。
总结
该研究系统地揭示了m1Ψ修饰通过直接调控核糖体动态来增强蛋白表达的分子机制,即在特定序列处减缓翻译延伸的同时促进翻译起始。这些发现不仅加深了我们对mRNA修饰生物学功能的理解,也为未来设计和优化基于mRNA的疗法提供了重要的理论指导,强调了编码序列的组成是决定修饰效果的关键因素。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
