导读
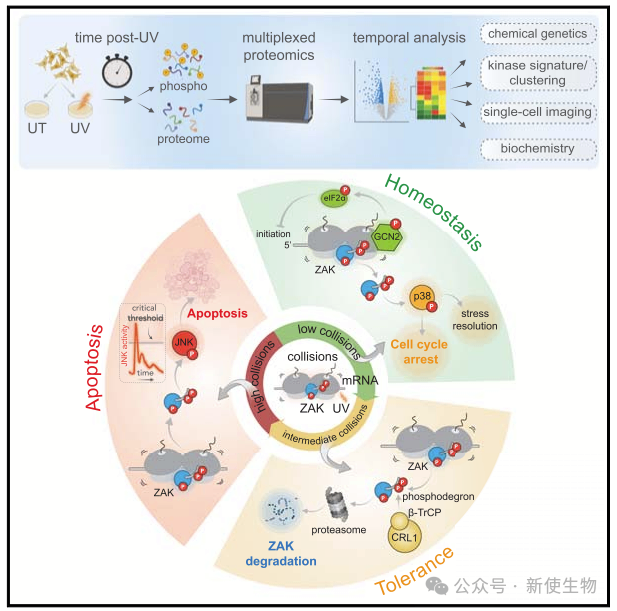
细胞通过信号级联调控基因表达和激活压力反应来应对环境变化。当无法解决压力时,细胞会触发程序性细胞死亡以防止损害。核糖体作为主要的压力传感器,激活决定细胞命运的信号通路。
A )在无压力状态下,核糖体通过调整mRNA的起始速率维持翻译稳态。
B)然而,核糖体偶尔会遇到由基因表达缺陷或化学损伤引起的问题mRNA,导致核糖体停滞和碰撞,招募质量控制因子降解mRNA和新生肽并拯救停滞的核糖体,但过度碰撞会使核糖体成为信号平台,启动全局性的压力反应。
紫外线诱导DNA和RNA损伤,激活DNA损伤反应(DDR)和核糖体毒性压力反应(RSR):
1)紫外线辐射诱导DNA损伤并激活DNA损伤反应(DDR)通路,导致复制叉停滞并激活ATR和CHEK1以解决复制压力并维持基因组完整性。
2)紫外线还通过光化学反应引起RNA损伤,导致核糖体在富含嘧啶的损伤密码子上停滞。
早期研究表明,核糖体毒性压力激活p38和JNK MAPK。随后研究确定ZAKα(简称ZAK)是响应核糖体毒性压力的上游MAPK激酶激酶(MAP3K),并且紫外线诱导的翻译功能障碍也与GCN2和ISR(综合压力反应)激活有关。
该团队之前研究表明,核糖体碰撞直接激活ZAK和GCN2激酶,ZAK与延伸核糖体结合并在碰撞时激活,随后激活p38和JNK以触发细胞周期停滞和凋亡。碰撞还激活GCN2,导致eIF2α磷酸化和通过ISR抑制全局蛋白质合成。
虽然这些研究揭示了碰撞的核糖体激活RSR和ISR通路,但未能明确细胞如何通过整合ZAK和GCN2通路来协调对碰撞的测量和响应以确定细胞命运。
2024年6月5日,约翰霍普金斯大学医学院分子生物学与遗传学系Rachel Green团队在Cell上发表了一篇题为“The ribotoxic stress response drives UV-mediated cell death”的论文,文章发现紫外线引发的即时核糖体毒性压力反应主要由ZAK信号驱动,并通过GCN2和ZAK自磷酸化降解等负反馈机制调控,确保细胞对压力的受控响应。

文章索引
【标题】The ribotoxic stress response drives UV-mediated cell death
【发表期刊】Cell
【发表日期】2024年6月5日
【作者及团队】约翰霍普金斯大学医学院分子生物学与遗传学系Rachel Green团队
【IF】66.85
研究结果
一. 紫外线辐射的即时早期反应主要由核糖体介导的信号传导主导
作者研究了紫外线(UV)辐射引起核糖体碰撞的能力,并将其与放线菌素D(ANS)进行了比较。
UV处理使作者能够监测细胞从瞬时应激中恢复的动态变化。研究发现,ANS和UV-C处理均增加了核糖体蛋白eS10的泛素化和ZAK、p38、JNK的磷酸化。
较低强度的UV辐射导致更多细胞在G2期停滞,而较高强度的UV辐射则显著增加了凋亡。核糖体碰撞在UV处理后几分钟内累积,并在数小时内清除。
总之,UV辐射引起的核糖体介导信号在早期反应中起关键作用,细胞对UV的反应表现为显著的时间动态变化。
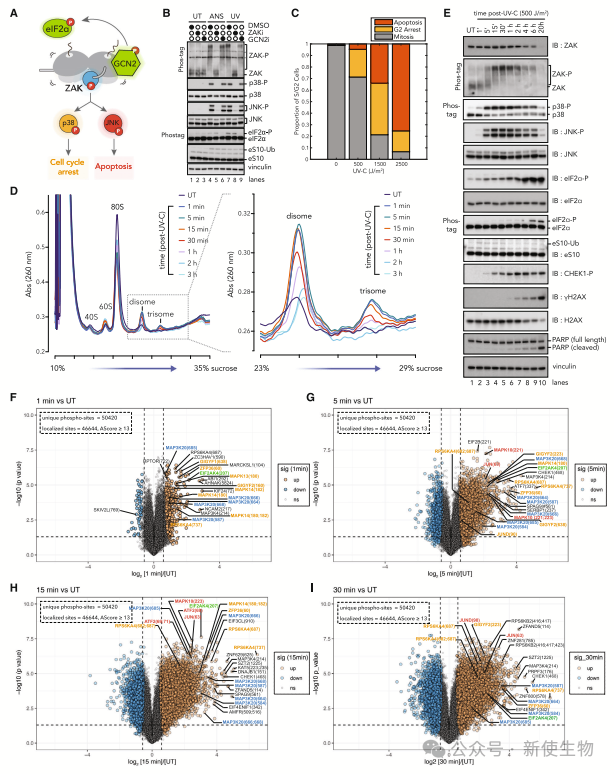
二. ZAK和GCN2定义了细胞对紫外线应激反应的即时早期磷酸化蛋白质组
作者研究了ZAK和GCN2在紫外线应激下对蛋白质磷酸化的影响。结果显示,ZAK通过p38和JNK信号通路调节核糖体质量控制和其他关键蛋白的磷酸化。
GCN2也调节了UV响应中的磷酸化事件,影响了p38信号通路。
此外,他们发现ZAK介导的响应和ATR介导的DNA损伤响应在细胞中是独立的。

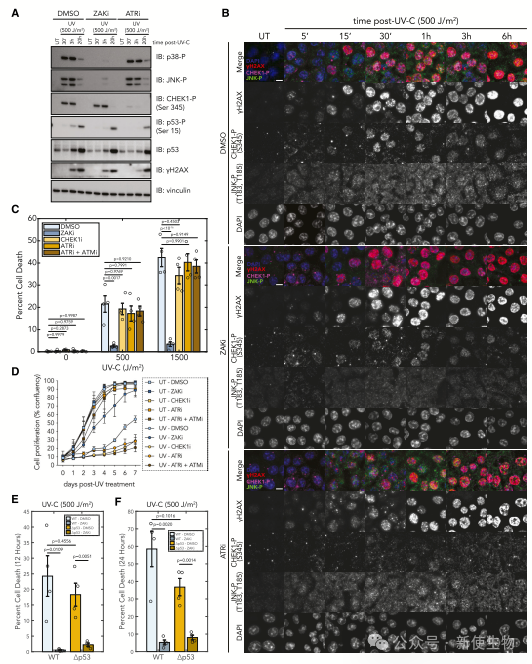
三. 紫外线诱导的细胞死亡是通过ZAK途径介导的,而不是通过DDR途径
ZAK介导的RSR和ATR介导的DDR之间缺乏交叉联系。ZAK抑制阻断了p38和JNK的磷酸化,ATR抑制阻断了CHEK1的磷酸化。
细胞对UV的反应中,ZAK主要驱动细胞凋亡。ZAK抑制剂使细胞对UV诱导的凋亡和生长抑制产生了抵抗力,效果超过了ATR和CHEK1抑制剂。
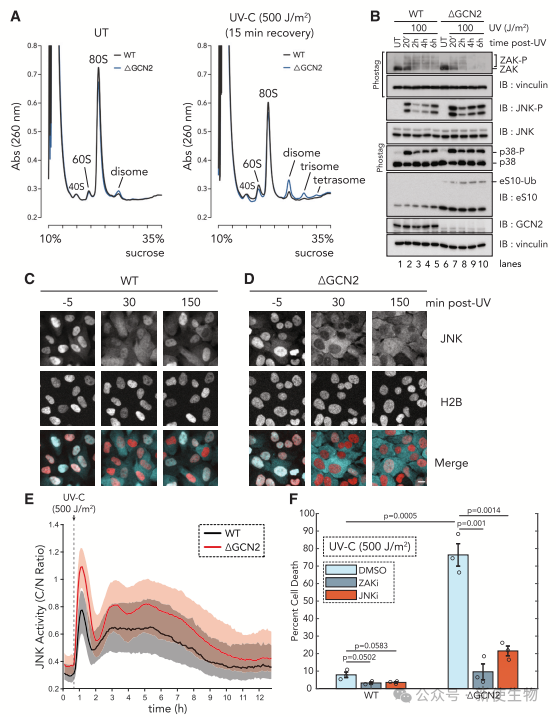
四. GCN2通过限制核糖体负载来防止ZAK介导的细胞死亡
作者的磷酸蛋白组学数据表明GCN2通过磷酸化eIF2α和抑制mTOR活性限制核糖体的起始翻译,防止受损mRNA导致的碰撞核糖体的积累。
在DGCN2细胞中,他们观察到持续的高水平JNK活性,但p38活性增加最小。DGCN2细胞对UV的敏感性增加,主要是因为其导致的凋亡水平显著增加,可以通过ZAKi或JNKi逆转。
五. ZAK的自磷酸化调节核糖体的解离和之后的降解
ZAK的降解发生在激活后,涉及多种磷酸化位点。初始激活包括Thr-161和Ser-165的自磷酸化。
UV处理后,野生型ZAK从多核糖体解离,而激酶失活突变体和Cluster 2磷酸突变体仍然结合。
ZAK的降解通过CRL1 Cullin-RING连接酶介导的泛素-蛋白酶体途径完成,这些结果表明核糖体介导的激活对降解至关重要。
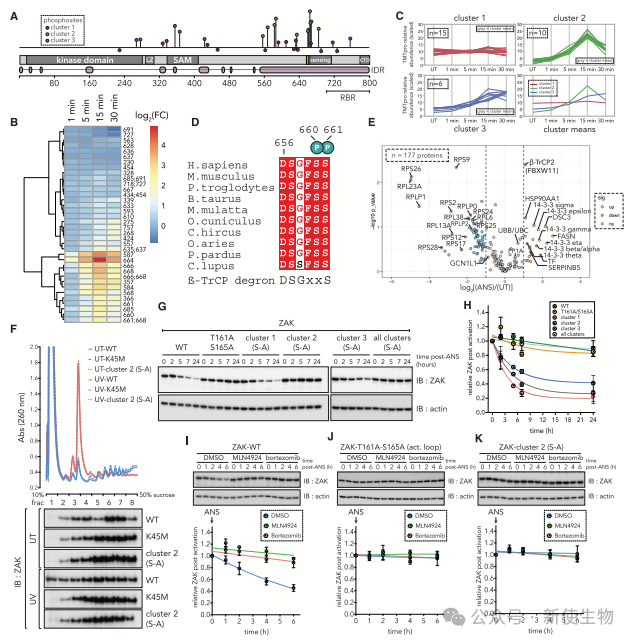
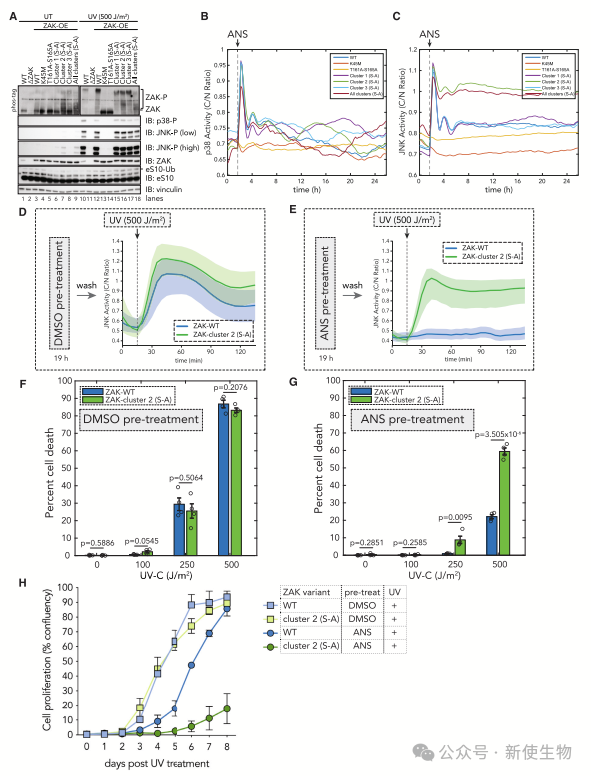
六. ZAK降解在持续核糖体毒性应激条件下限制细胞凋亡并诱导耐受
磷酸突变体(S-A)在基础条件下显示轻度过度活跃和JNK磷酸化升高。UV处理后,WT细胞显示ZAK、p38和JNK磷酸化增加,而激酶失活变体无此现象。
ANS预处理使WT细胞对后续UV无JNK反应,而磷酸突变体表现强烈反应,表明ZAK周转使细胞耐受持续应激。
中等核毒性应激下的ZAK降解减少了随后应激暴露的细胞凋亡,突变体凋亡增加,生长受阻。ZAK降解限制凋亡并在持续应激下促进耐受性。
总结
紫外线辐射不仅损害DNA,还会损害RNA,触发核糖体碰撞和核糖体应激应答(RSR)。本文发现紫外线诱导的细胞凋亡是通过RSR激酶ZAK介导的,而非DDR。GCN2限制核糖体碰撞并减弱RSR,ZAK活性导致其自身降解,调节了细胞对RNA损伤的响应,凸显了ZAK作为细胞防护者的重要性。
新使生物(neoribo)推出国内首款超高分辨率翻译组ribo-seq建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高小肽的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。


了解更多核糖体分析请联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们