导读
泛素化是一种可逆的翻译后修饰,通过泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)的作用,将泛素(Ub)添加到底物蛋白的赖氨酸残基上。多轮泛素化形成多泛素链,这些链通过不同的赖氨酸连接。去泛素化酶(DUBs)逆转这一过程,通过编辑或移除多泛素链。
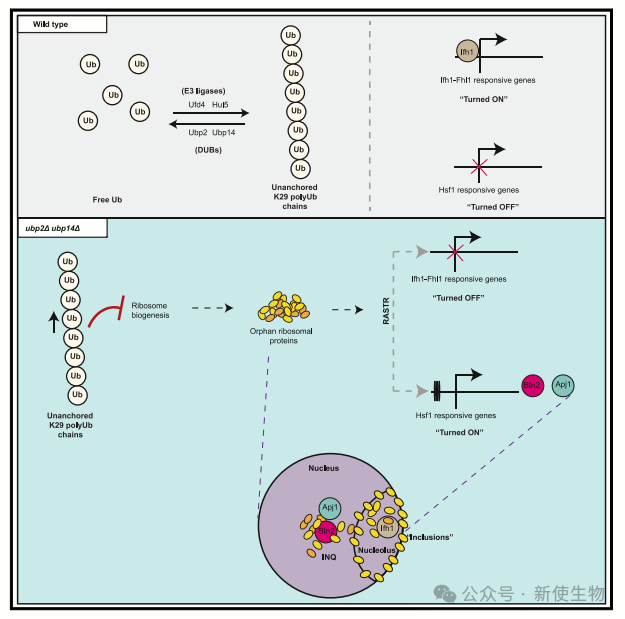
泛素化调控多种生物过程,包括核糖体的稳态。在酵母中,大量rRNA和核糖体蛋白基因协调调控以确保核糖体组装。孤立的核糖体蛋白若未组装会聚集,并由E3连接酶Tom1降解,未降解则触发核糖体组装应激反应(RASTR),通过隔离Ifh1和激活HSF1调控网络来下调核糖体蛋白基因表达。HSF1诱导的BTN2编码的伴侣蛋白在应激响应中控制细胞核内质量控制区(INQ)形成,处理错误折叠蛋白。
许多核糖体蛋白被泛素化,研究表明这一机制对核糖体功能和质量控制重要。例如,非功能性核糖体在被E3连接酶复合物泛素化后解离,并被蛋白酶体降解。
停滞和碰撞的核糖体在Rps10和Rps7被泛素化后也解离,Rps7的泛素化对翻译效率和应激响应下的选择性mRNA翻译至关重要。
虽然锚定的单泛素和多泛素修饰在核糖体蛋白降解或翻译控制中的角色是明确的,但未锚定多泛素链在核糖体生物学中的潜在作用仍未被探索。
2024年6月12日,多伦多大学唐纳利细胞和生物分子研究中心Brenda J. Andrews团队在Molecular Cell上发表了一篇题为“K29-linked free polyubiquitin chains affect ribosome biogenesis and direct ribosomal proteins to the intranuclear quality control compartment”的论文,揭示了泛素稳态和核糖体组装的功能连接,并提供了核糖体病突变相关细胞毒性的潜在机制。

文章索引
【标题】K29-linked free polyubiquitin chains affect ribosome biogenesis and direct ribosomal proteins to the intranuclear quality control compartment
【发表期刊】Molecular Cell
【发表日期】2024年6月12日
【作者及团队】多伦多大学唐纳利细胞和生物分子研究中心Brenda J. Andrews团队
【IF】15.58
研究结果
一. Ubp2和Ubp14在基因上是冗余的
UBP2和UBP14之间存在强烈的负遗传相互作用,双突变体在高温下表现出严重的生长缺陷,表明这两个基因在脱泛素过程中具有关键作用。双突变细胞积累了高分子量的泛素化蛋白质。
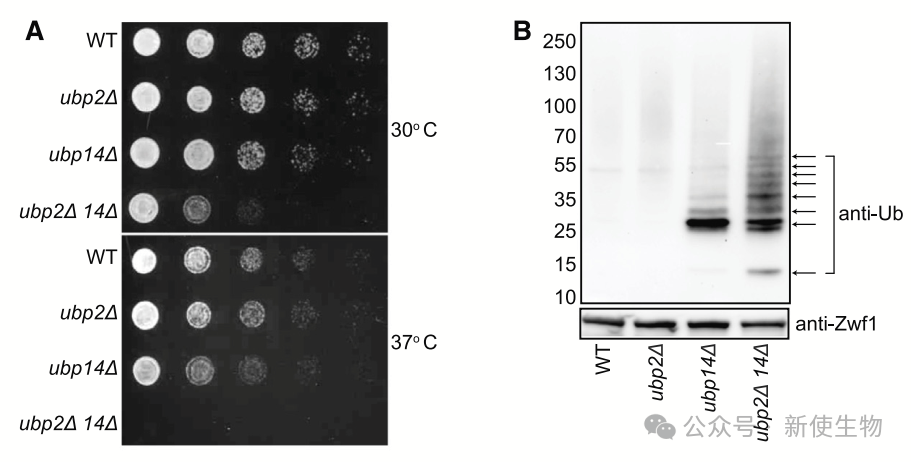
二. UBP2和UBP14回收K29连接的未锚定多泛素链
作者发现,缺乏UBP2和UBP14的双突变体在K29未锚定多泛素链累积时表现出严重的生长缺陷,特别是在高温下。
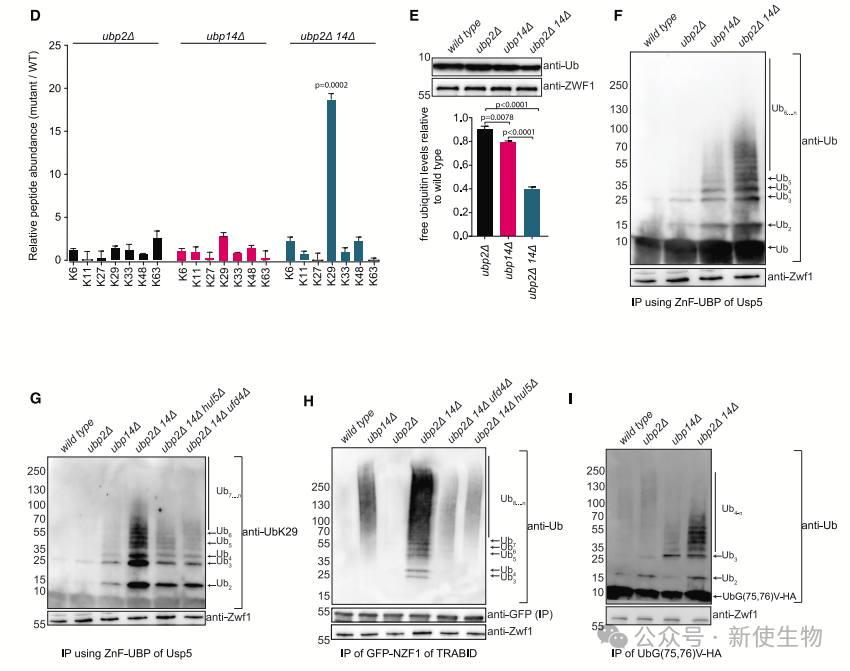
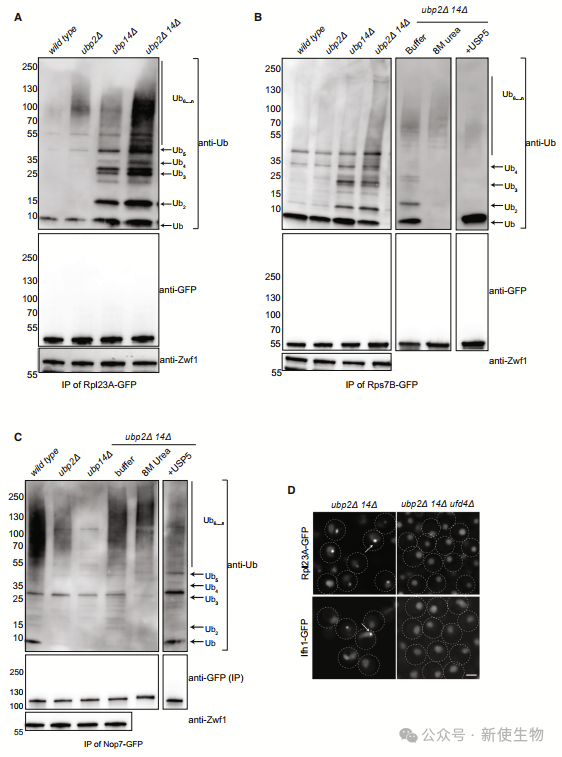
团队鉴定了突变体细胞中泛素化的蛋白质,发现UBP2和UBP14双突变体显著增加了K29连接的多泛素链,并减少了自由泛素池。
实验显示,这些高分子量泛素化物种与Usp5的ZnF-UBP结构域结合,并与识别K29链的TRABID的NZF1结构域共免疫沉淀,确认它们是未锚定的K29连接多泛素链。
结果表明,UBP2和UBP14在回收新合成的K29未锚定多泛素链方面协同作用,调节其水平对细胞应对蛋白毒性应激具有重要意义。
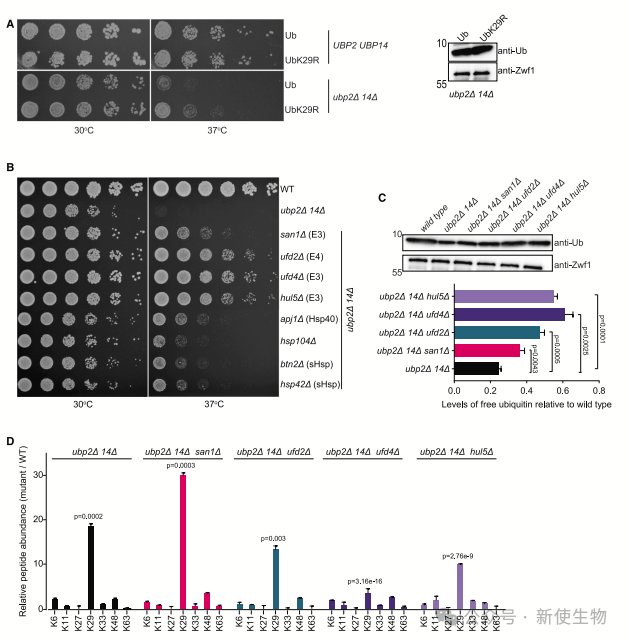
三. ubp2D ubp14D突变体的生长缺陷反映了K29链未锚定多泛素链的积累
通过将Ub的K29位点替换为精氨酸(UbK29R),作者发现ubp2D ubp14D双突变体中未观察到纤维聚集物结构的形成,并且UbK29R突变部分抑制了其生长缺陷。
作者推测抑制负责组装K29链的E3连接酶基因会减轻ubp2D ubp14D双突变体的生长缺陷。
通过SGA方法,他们发现SAN1、UFD2、UFD4、HUL5、APJ1、BTN2、HSP42和HSP104基因的缺失显著抑制了ubp2D ubp14D细胞在葡萄糖碳源上的温敏生长缺陷。
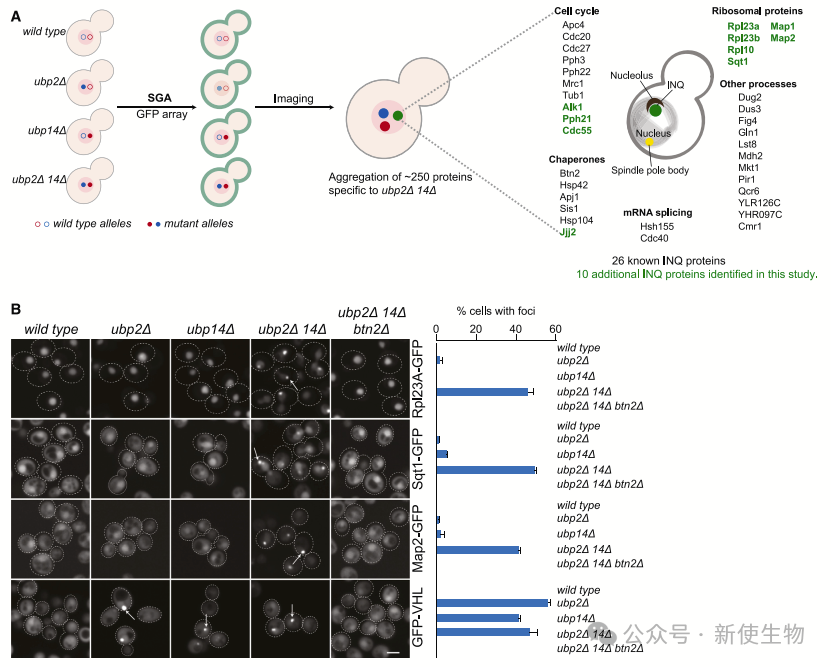
四. 蛋白质组广泛成像揭示ubp2D ubp14D双突变体在蛋白质丰度和包含体形成中的缺陷
团队利用GFP,研究了K29链未锚定多泛素链在蛋白质组水平的影响。
作者发现在ubp2D ubp14D双突变体中,约250种蛋白质形成特异的点状结构,其中包括全部26种已知聚集于INQ的蛋白质。通过删除BTN2蛋白,确定了其中36种蛋白质是真正的INQ组分,其中包括10种先前未知的成分。
此外,VHL-GFP在ubp2D、ubp14D和ubp2D ubp14D突变体中也在INQ聚集,这表明UBP2和UBP14的缺失会导致INQ核区蛋白质的聚集。
在ubp2D ubp14D双突变体中,INQ聚集体不对称地分布到母细胞和子细胞,暗示UBP2和UBP14参与了这一过程,这是母细胞复制老化和子细胞更新的特征。
五. UBP2和UBP14的丧失导致核糖体生物合成缺陷
ubp2D ubp14D双突变体中,约250种蛋白质富集于核糖体相关的结构,包括10种新发现的INQ组分,如核糖体蛋白和翻译因子。
这些蛋白质在核糖体融合蛋白的处理上没有缺陷,但核糖体蛋白Sqt1的稳定性降低,表明在INQ中可能发生了蛋白质降解。
此外,ubp2D ubp14D突变体显示35S rRNA处理缺陷,并在多聚核糖体分析中观察到60S/40S亚基比例降低。许多核糖体和RiBi蛋白在这些细胞中被错误定位和聚集,表明核糖体生物合成异常。
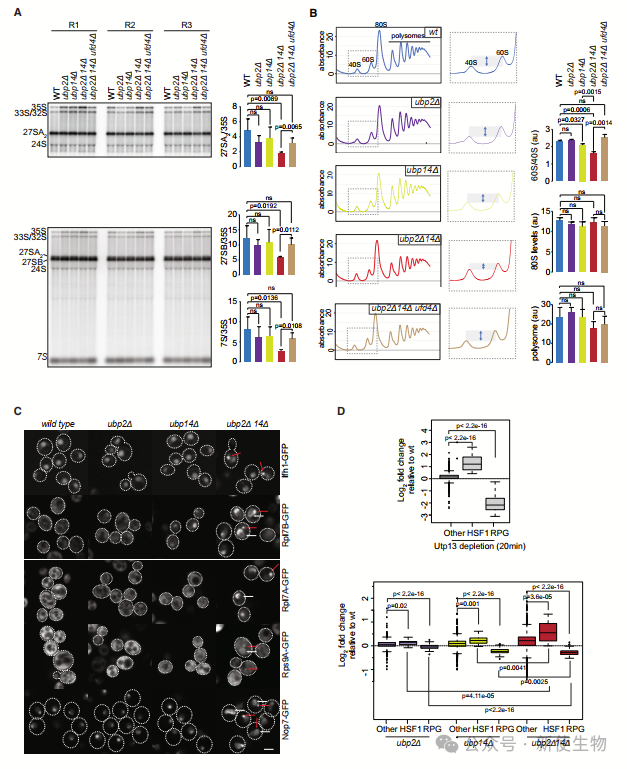
六. UBP2和UBP14依赖的蛋白质聚集和RiBi缺陷依赖于未锚定的聚泛素链
K48和K63链的未锚定聚泛素链通过与效应蛋白的物理相互作用影响细胞信号传导。
在ubp2D ubp14D双突变体中,作者观察到部分未锚定的K29链聚泛素链与核糖体蛋白结合,包括40S、60S、80S和多体分离物。
此外,删除E3连接酶UFD4基因能减少K29链的未锚定聚泛素链积累,从而抑制ubp2D ubp14D双突变体中多个核糖体生物合成缺陷,如rRNA加工异常、60S/40S比率不正常和核糖体蛋白的聚集。
这些发现表明,在缺乏UBP2和UBP14的情况下积累的K29链未锚定聚泛素链对细胞生长和核糖体生物合成产生负面影响,可能是通过与核糖体蛋白的物理相互作用实现的。
总结
本文研究了核糖体组装的精确调控,特别关注了几种酵母蛋白稳态酶,如去泛素化酶Ubp2和Ubp14,以及连接酶Ufd4和Hul5在调节细胞内K29-链式非连接型泛素化链水平中的作用。这些链的积累干扰核糖体的组装,触发核糖体组装应激反应(RASTR),并导致核糖体蛋白质在胞核质量控制区(INQ)中的沉淀。这些发现揭示了INQ的生理重要性,并深入探讨了与核糖体病相关的细胞毒性机制。
新使生物(neoribo)推出国内首款超高分辨率翻译组建库ribo-seq试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。


如需了解翻译组请联系杭州新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们