导读
四环素是一类广谱抗生素,通过靶向细菌核糖体抑制其翻译过程。自20世纪50年代发现金霉素以来,四环素广泛用于治疗人类感染和动物饲料中。由于耐药菌的出现,新一代四环素如替加环素(tigecycline)被开发出来。
替加环素是2005年FDA批准的第三代四环素(糖酰胺环素),对多种革兰氏阳性、革兰氏阴性和厌氧菌,包括耐甲氧西林金黄色葡萄球菌(MRSA)和多药耐药的鲍曼不动杆菌有效。
替加环素通过靶向细菌70S核糖体阻止A位tRNA进入,亲和力比四环素高约20倍,克服了大多数四环素耐药机制。
此外,替加环素还具有抗炎和抑制肿瘤转移的非抗生素活性,对急性髓性白血病和多种其他癌症有效,其抗肿瘤活性可能源于抑制真核细胞的线粒体蛋白质翻译。
值得注意的是,依赖线粒体功能增加的肿瘤细胞对替加环素的敏感性增加,使其在化疗中被越来越多地使用。
然而,替加环素有较严重的副作用,并出现了耐药菌株。需要进一步研究其抑制机制,以指导未来药物设计。
2024年6月28日,复旦大学程净东团队在Nature Communications上发表了一篇题为“Structural basis for differential inhibition of eukaryotic ribosomes by tigecycline”的论文,文章发现替加环素不仅阻止A位tRNA的进入,还直接阻断了人类55S线粒体核糖体的肽基转移中心(PTC)。在高浓度下,替加环素还结合于人类80S核糖体的多个位点,为其对胞质翻译仅有轻微抑制活性提供了结构基础,这些发现为未来的药物设计和治疗提供了新的方向。

文章索引
【标题】Structural basis for differential inhibition of eukaryotic ribosomes by tigecycline
【发表期刊】Nature Communications
【发表日期】2024年6月28日
【作者及团队】复旦大学程净东团队
【IF】16.6
研究结果
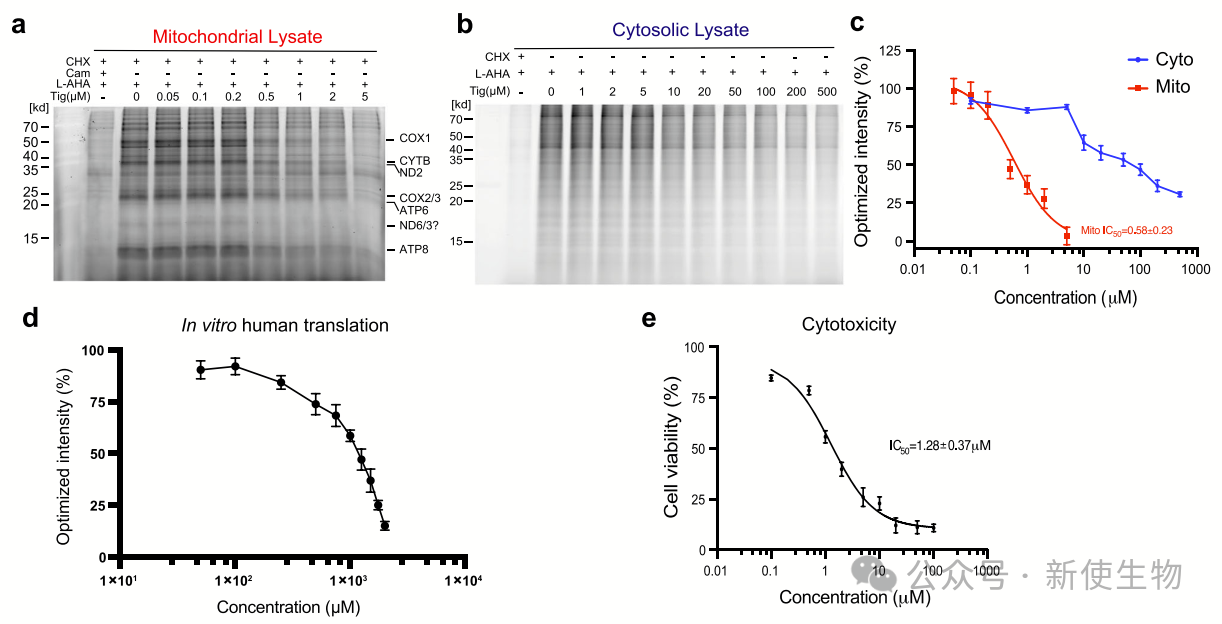
一. 替加环素通过靶向线粒体核糖体抑制人类蛋白质翻译
由于替加环素在化疗和抑制细菌翻译中的高效性,作者研究了其对人类核糖体的抑制特性,监测翻译活性后发现:
A)55S线粒体核糖体:替加环素显著抑制其翻译活性,IC50约为0.6 µM,显示其有效靶向线粒体核糖体。
B)80S胞质核糖体:替加环素仅轻微抑制,未能完全抑制其活性,显示出相对耐药性。
替加环素对人类细胞的总体细胞毒性IC50约为1.3 µM,接近临床治疗中的生理浓度。综上所述,替加环素主要靶向人类55S线粒体核糖体。
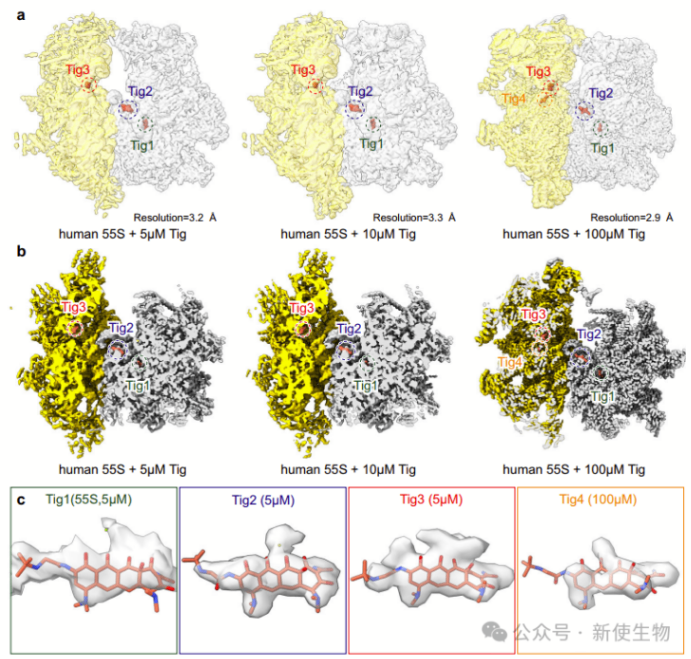
二. 替加环素与人类线粒体核糖体的冷冻电镜结构
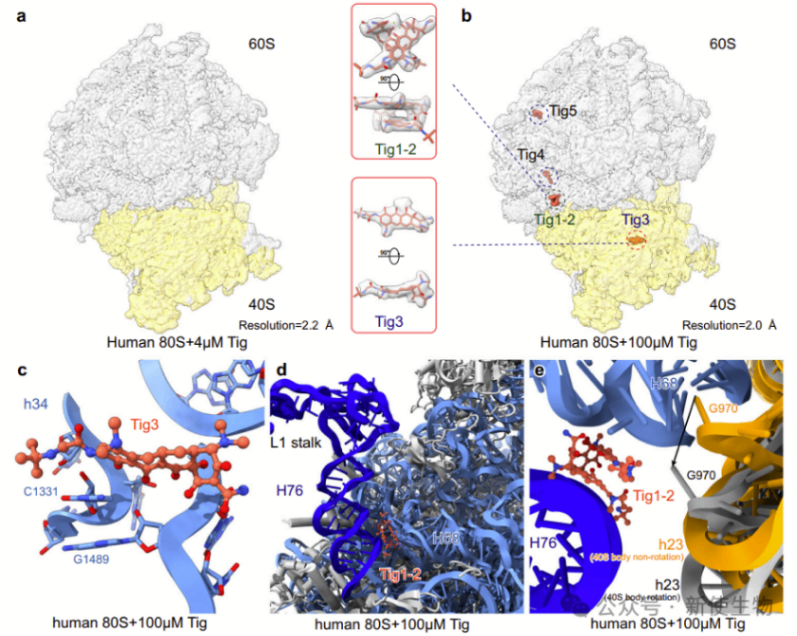
冷冻电镜结构分析显示,高浓度(100 µM)替加环素与55S核糖体结合时,能够分辨出四个替加环素分子(Tig1-4)。在低浓度(5 µM或10 µM)下,只能分辨出三个替加环素分子(Tig1-3)。
替加环素分子在55S核糖体中显示出明显的结合位置,其中部分分子位于28S小亚基的mRNA结合隧道附近,另一部分结合在39S大亚基的肽基转移中心及其附近。
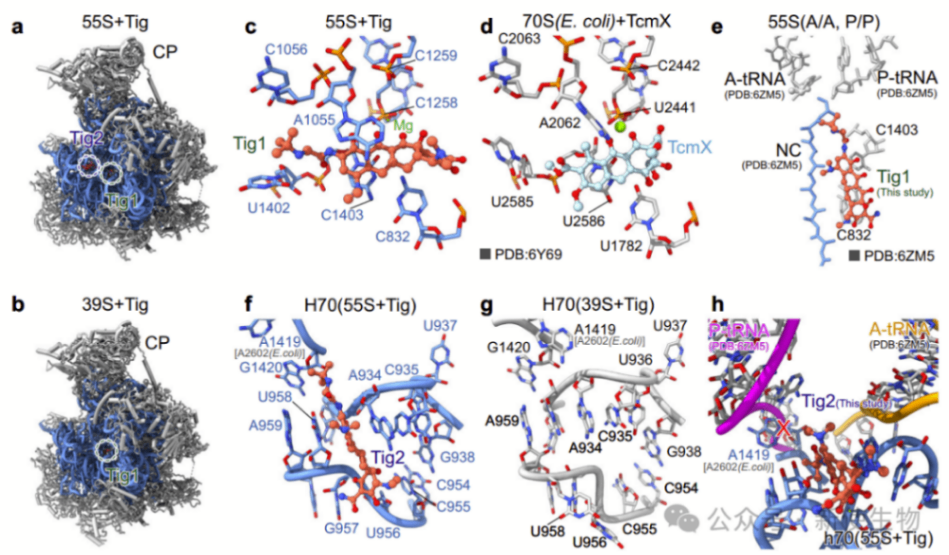
三. Tig1和Tig2与线粒体核糖体的肽基转移中心结合
替加环素在细菌70S核糖体中的抑制机制类似于四环素,通过紧密结合于30S小亚基阻止入口A位tRNA的结合。然而,在人类55S线粒体核糖体中,替加环素的两个分子(Tig1和Tig2)意外地结合到39S大亚基上。
Tig1直接结合到39S大亚基的肽基转移中心(PTC),与核苷酸A1055和非经典的C1403:C832碱基对形成稳定的π-π堆叠,并通过镁离子与C1258-C1259骨架相互作用。
Tig2结合到16S rRNA的H70区域,导致构象变化,可能影响tRNA从A位向P位的转位路径。
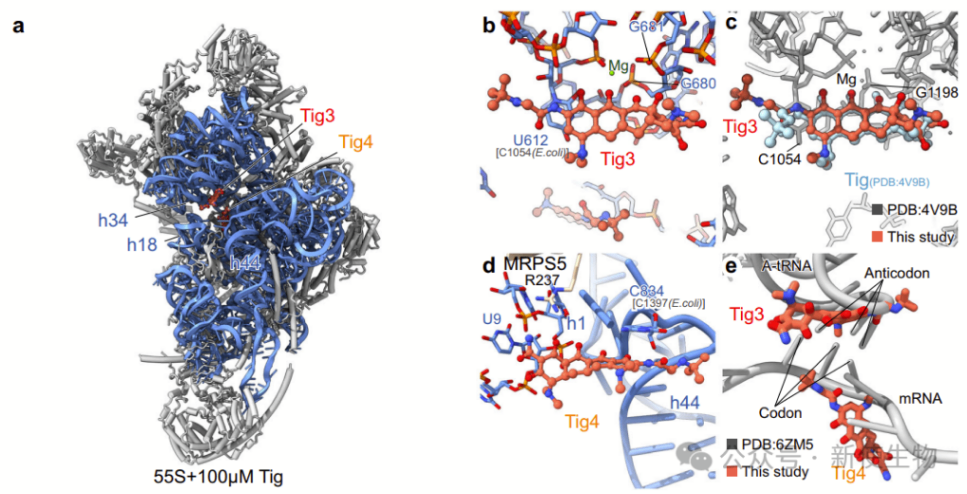
四. Tig3和Tig4结合到28S小亚基上的A位
替加环素不仅与人类55S线粒体核糖体的39S大亚基结合,还与28S小亚基结合。
Tig3是主要结合到28S小亚基的位点,与细菌核糖体上的主要结合位点相似。
Tig4则是一个次要结合位点,仅在高浓度替加环素下观察到。这些结合位点可能通过空间位阻的方式阻止A位tRNA的进入,从而影响蛋白质合成。
五. 在生理条件下,替加环素不结合人类80S核糖体
在临床使用条件下,替加环素对人类80S核糖体的结合和抑制效果较弱。通过高盐和普罗米西星处理,作者重新组装了空的人类80S核糖体,并使用冷冻电镜单颗粒分析系统地研究了替加环素在不同浓度下的作用。
结果显示,低浓度(4 µM)的替加环素不结合人类80S核糖体,而在高浓度下(100 µM),观察到五个替加环素分子与80S核糖体结合。这些分子在不同位置的结合可能通过限制核糖体的构象动态,尤其是在L1柄区域附近,对翻译过程产生轻微的抑制作用。
六. 替加环素在原生真核80S核糖体上结合多个位点
为深入探讨替加环素对细胞质翻译的影响,作者从人类HEK293细胞中提取了高剂量替加环素(170 µM)处理后的原生态80S核糖体复合物。
通过冷冻电镜单粒子分析和三维分类,他们获得了四种不同的核糖体结构,显示不同数量的替加环素结合位点和不同的翻译状态。
在人类和酵母80S核糖体中,替加环素主要结合在外围区域,对翻译影响较小,但部分分子也位于重要的结合位点,如E位tRNA和40S头部的区域。

总结
本文研究发现,在临床相关浓度下,替加环素能有效作用于人类55S线粒体核糖体,可能通过阻碍A位tRNA的结合和阻断肽转移中心。在生理浓度下,替加环素不结合人类80S核糖体,但在高浓度下,除了阻断A位点外,还能在另一个保守结合位点影响80S核糖体的L1梗突运动。替加环素观察到的不同结合特性可能为药物设计和治疗开辟新的途径。
新使生物(neoribo)推出国内首款超高分辨率翻译组ribo-seq建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可联系杭州新使生物科技有限公司

关注新使生物,了解更多翻译组前沿信息


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们