导读
转录后RNA修饰在中枢神经系统(CNS)复杂功能中扮演重要角色。其中,腺苷核苷酸向次黄嘌呤(A-to-I)的转化在人类大脑中广泛存在,这导致A-to-G的转录后转变。
ADAR酶驱动RNA转录本的这些转化,支持多种分子功能。
A)ADAR1存在P110和P150两种同工型,负责编辑内源性长双链RNA的A-to-I。P150同工型可被干扰素诱导,上调A-to-I编辑活性,关键在于调节先天免疫反应。
B)ADAR2在CNS表达,编辑蛋白编码序列产生功能多样的蛋白同工型,对典型神经发育至关重要。
C)ADAR3仅在大脑表达,不能催化A-to-I转化,被认为是A-to-I编辑的负调控因子。
在哺乳动物大脑中,A-to-I编辑位点高度调控,涉及解剖区域、细胞类型、神经元成熟和大脑发育。大脑中A-to-I编辑的异常调控与多种神经疾病的发病机制相关,突显其在CNS中的生理重要性。
然而,当前对CNS A-to-I编辑的认识主要基于死后组织的研究,这可能受到多种因素的影响,如缺血反应和死后诱导的免疫反应,这些可能扭曲对CNS RNA编辑的全面理解。
2024年6月26日,美国西奈山伊坎医学院Michael S. Breen团队在Nature Communications上发表了一篇题为“Divergent landscapes of A-to-I editing in postmortem and living human brain”的论文,研究比较了死后和活体人类额外前额皮质(DLPFC)组织中A-to-I编辑,特别是在非神经元细胞类型中。他们发现A-to-I编辑谱存在显著差异,这些发现不仅深化了对RNA编辑生物学的理解,也为死后大脑组织在研究人类大脑健康和疾病相关的A-to-I编辑中的实用性提供了支持和背景。

文章索引
【标题】Divergent landscapes of A-to-I editing in postmortem and living human brain
【发表期刊】Nature Communications
【发表日期】2024年6月26日
【作者及团队】美国西奈山伊坎医学院Michael S. Breen团队
【IF】16.6
研究结果
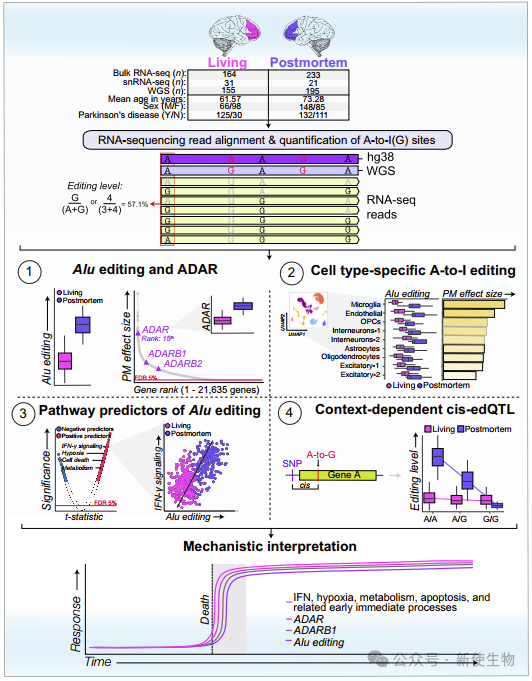
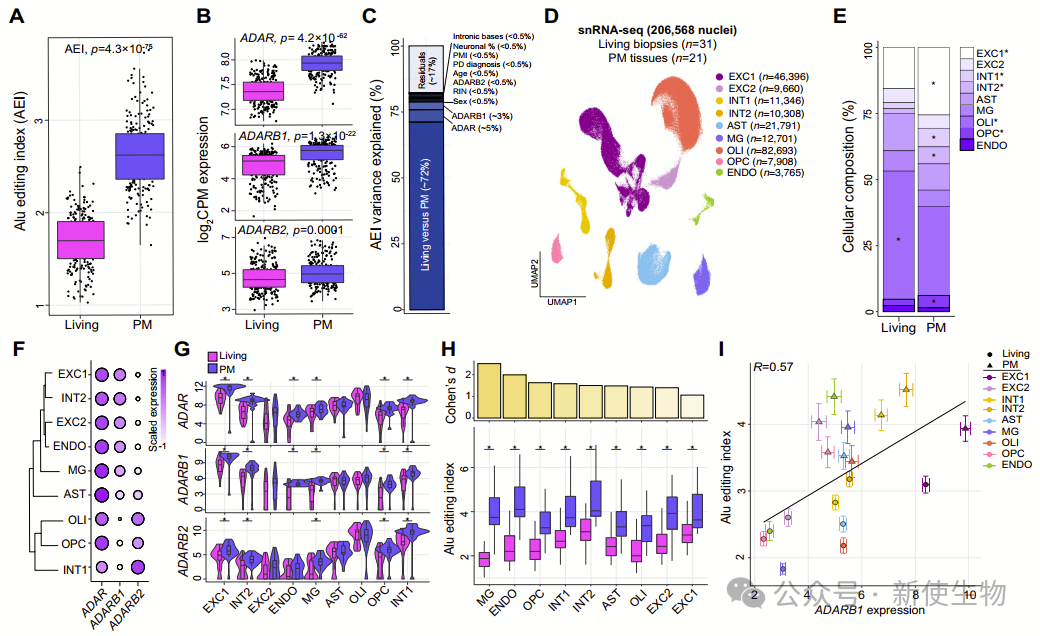
一. 全局的Alu编辑在死后前额皮质中升高
作者首先计算了每个样本的Alu编辑指数(AEI),用以量化全局Alu编辑活动。结果显示,相比活体DLPFC,死后DLPFC中AEI显著增加。
转录组分析表明,这种变化伴随着死后DLPFC中ADAR、ADARB1和ADARB2的显著上调。线性混合模型显示,生死状态差异解释了全局Alu编辑变异的大部分(约72%)。
进一步分析表明,延长的PMI和RNA降解对死后DLPFC中全局Alu编辑的影响较小,这些因素无法完全解释观察到的差异。
单核RNA测序数据验证了这些发现,并显示在死后DLPFC中,微胶质细胞、内皮细胞和寡突胶质细胞前体细胞中的全局Alu编辑显著增加,伴随着ADAR、ADARB1和ADARB2的表达增加。
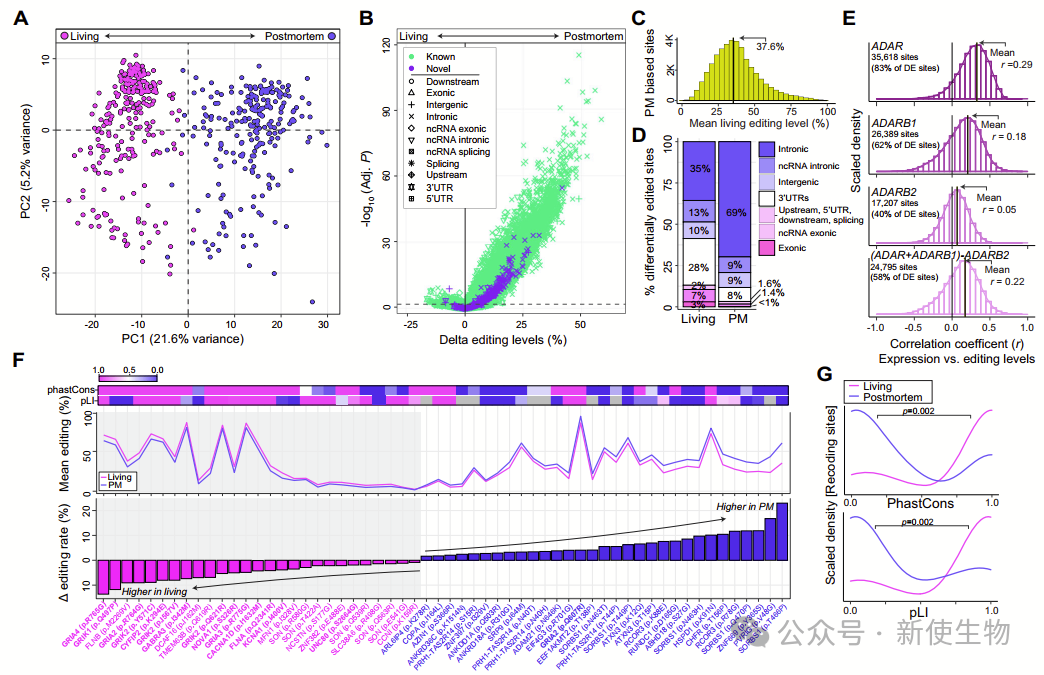
二. 活体和死后DLPFC中高动态的A-to-I编辑和RNA重新编码
RNA编辑在活体和死后DLPFC之间存在显著差异,作者通过两种方法进行探索。
首先,分析显示在死后组织中显著富集的28,417个A-to-I位点和在活体组织中富集的1,436个位点,大部分位于内含子区域。这些富集模式不能通过基因表达水平的变化来解释。
其次,研究发现在生前和死后DLPFC之间的54,825个A-to-I位点中,主成分分析能够明显区分这两组组织,其中PC1与它们的差异高度相关。
统计分析进一步识别了41,044个在死后组织中显示更高编辑的位点和1,449个在活体组织中显示更高编辑的位点。这些发现突显了RNA编辑在生前和死后大脑皮层中的高度动态性和差异。
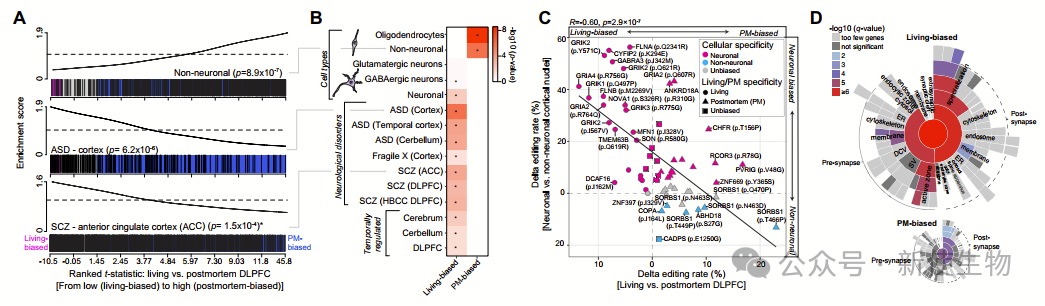
三. 注释在细胞、发育和疾病尺度上动态调节的位点
作者分析了生前和死后DLPFC之间RNA编辑位点在细胞类型、发育和疾病相关性上的差异。结果显示,死后偏向的编辑位点主要富集于非神经元细胞类型,尤其是寡脂质细胞。
而生前偏向的位点则显著富集于神经元细胞类型,特别是GABA能神经元。对RNA重编码位点的分析表明,它们在神经系统功能中具有特异性作用。
四. 深入理解死后组织中Alu编辑显著增加的解释:干扰素激活和缺氧
作者进一步探索了解释死后组织中RNA编辑显著增加的生物过程。
通过基因集变异分析,他们发现多个免疫和炎症反应、缺氧、细胞内信号传导、凋亡和细胞代谢相关的生物过程显著预测了全局Alu编辑的变化。这些生物过程不仅能有效区分活体和死后DLPFC样本,还与ADAR基因表达显著增加密切相关。
进一步的体外模型实验证明,γ-干扰素和缺氧条件显著诱导了全局Alu编辑的增加,这些发现或许部分解释了死后DLPFC中AEI增加的现象。
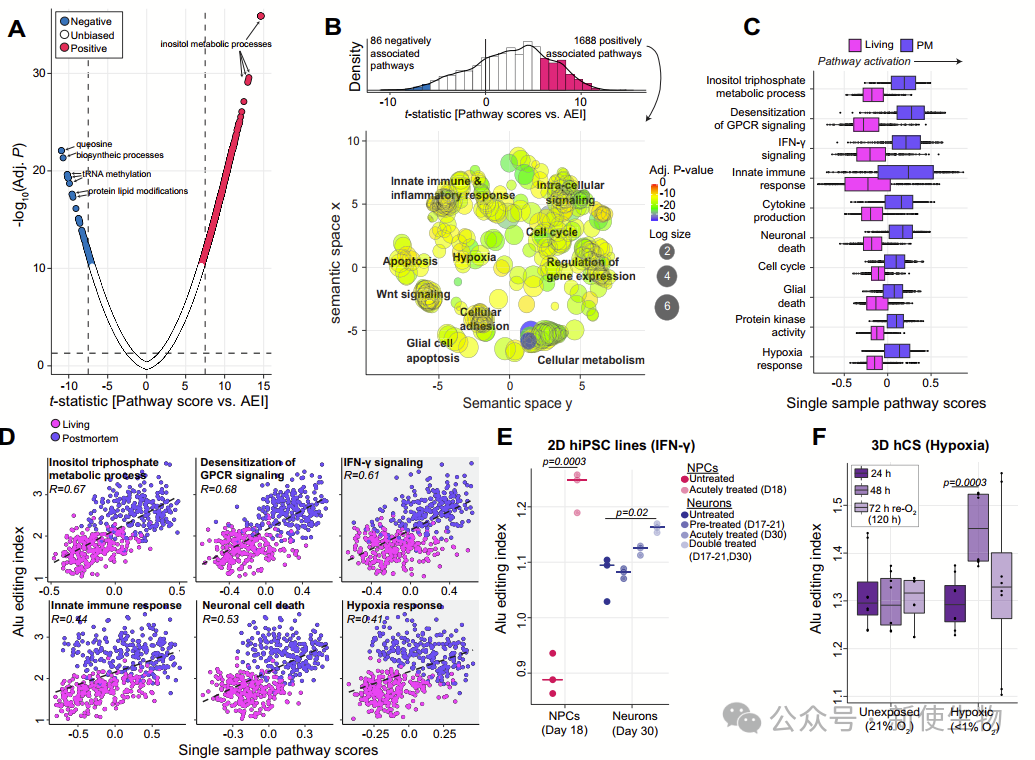
五. 活体和死后额外前额皮质(DLPFC)之间的环境相关edQTL映射
作者利用全基因组测序数据探索了活体和死后DLPFC样本中RNA编辑的定量性状位点(edQTLs)。
通过主要的和交互作用分析,他们发现了4858个和2362个唯一的edQTLs,这些位点主要分布在内含子和3'UTR区域。
主要分析的edQTLs能够解释大部分位点的编辑水平变异性,而交互作用分析显示出死后DLPFC中的特异性效应。这些结果为理解RNA编辑在不同条件下的调节机制提供了重要线索。
总结
本文通过比较前额皮质活体和死后组织中的A-to-I编辑发现显著差异。死后组织中超过70,000个A-to-I位点显示更高的编辑水平,与增加的ADAR和ADARB1表达密切相关,尤其在非神经元细胞中。常见的遗传变异也不同程度影响活体和死后组织中的A-to-I编辑水平。这些发现为解析人脑中RNA编辑的调控机制提供了重要见解。
新使生物NeoRibo推出国内首款超高分辨率翻译组Ribo-seq建库试剂盒。
我们的Ribo-seq核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可咨询杭州新使生物有限公司

关注新使生物,了解更多翻译组测序前沿信息


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们