导读
胰腺导管腺癌(PDAC)是难治性癌症,5年生存率仅12%,主要因晚期诊断和耐药性问题。尽管吉西他滨及其联合疗法在一定程度上有效,但耐药性迅速发展限制了疗效。因此,探索新型细胞死亡机制如铁死亡(ferroptosis)可能对克服耐药性和改善生存率有潜力。
铁死亡是一种由铁催化的脂质过氧化引起的细胞死亡,与细胞膜破裂有关。与传统的凋亡不同,铁死亡是由铁催化的脂质过氧化驱动的。
研究表明,铁死亡诱导不仅能直接杀死肿瘤细胞,还能与化疗、放疗、靶向疗法和免疫疗法协同作用。然而,肿瘤细胞可能通过多种机制获得对铁死亡的耐药性,例如通过上调抗氧化因子来降低铁死亡敏感性。
泛素化是一个多步骤的酶级联过程,其中E3泛素连接酶将泛素附加到蛋白质的赖氨酸残基上。RBCK1是RBR型E3泛素连接酶的一种,与炎症和免疫相关的LUBAC复合体有关。RBCK1在癌症中扮演重要角色:
A)RBCK1在肾细胞癌中促进p53的泛素化和降解
B)在乳腺癌中上调雌激素受体α和细胞周期蛋白B1
C)在胰腺癌中,RBCK1可能因剪接突变导致在细胞核内滞留
然而,目前RBCK1在胰腺导管腺癌(PDAC)中的具体作用尚不清楚。
2024年5月28日,北京协和医学院张太平团队在Free Radical Biology And Medicine上发表了一篇题为“E3 ubiquitin ligase RBCK1 confers ferroptosis resistance in pancreatic cancer by facilitating MFN2 degradation”的论文,研究利用Ribo-seq发现铁死亡诱导后,胰腺导管腺癌细胞经历了显著的翻译变化。E3泛素连接酶RBCK1在IKE处理后上调,并通过对MFN2进行多泛素化和促进其蛋白酶体降解,抑制铁死亡,从而减少线粒体ROS的产生,这为RBCK1介导的铁死亡耐药提供了理论基础。

文章索引
【标题】E3 ubiquitin ligase RBCK1 confers ferroptosis resistance in pancreatic cancer by facilitating MFN2 degradation
【发表期刊】Free Radical Biology And Medicine
【发表日期】2024年5月28日
【作者及团队】北京协和医学院张太平团队
【IF】5.657
研究结果
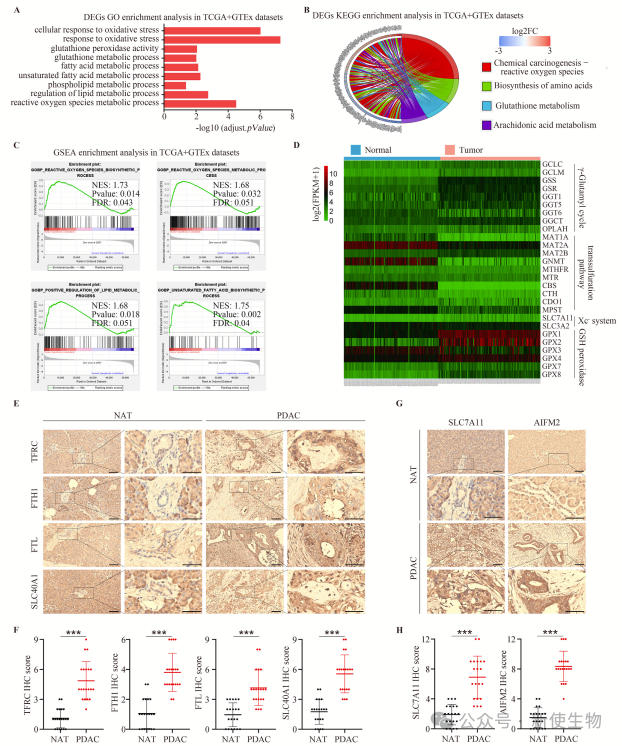
一. 在胰腺癌中,铁死亡受到抑制
研究表明,胰腺导管腺癌(PDAC)中铁死亡被抑制。PDAC组织表现出谷胱甘肽水平升高、可游离铁减少、以及铁死亡抑制因子(如SLC7A11和AIFM2)普遍上调,暗示铁死亡的抑制可能加速了PDAC的发生和发展。
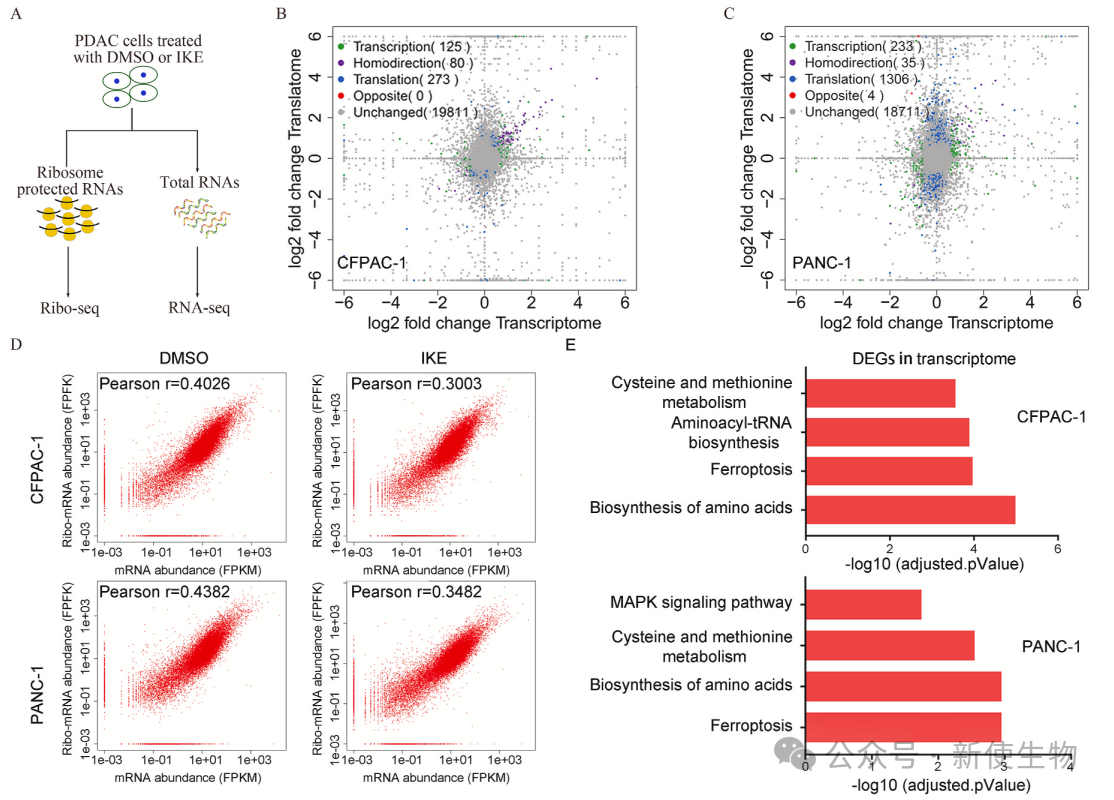
二. 铁死亡的诱导在胰腺导管腺癌(PDAC)细胞中引发了显著的翻译和转录变化
为了研究PDAC中的铁死亡抑制机制,作者评估了几种PDAC细胞系对铁死亡诱导剂IKE的敏感性。结果显示,大部分PDAC细胞系对IKE敏感,并且这种效应可以通过铁死亡抑制剂Fer-1逆转。
研究团队进一步利用RNA-seq和Ribo-seq核糖体印迹分析技术,发现了PDAC细胞在铁死亡诱导后发生了显著的转录和翻译变化,尤其是在翻译层面,暗示铁死亡主要通过翻译重编程被调控。
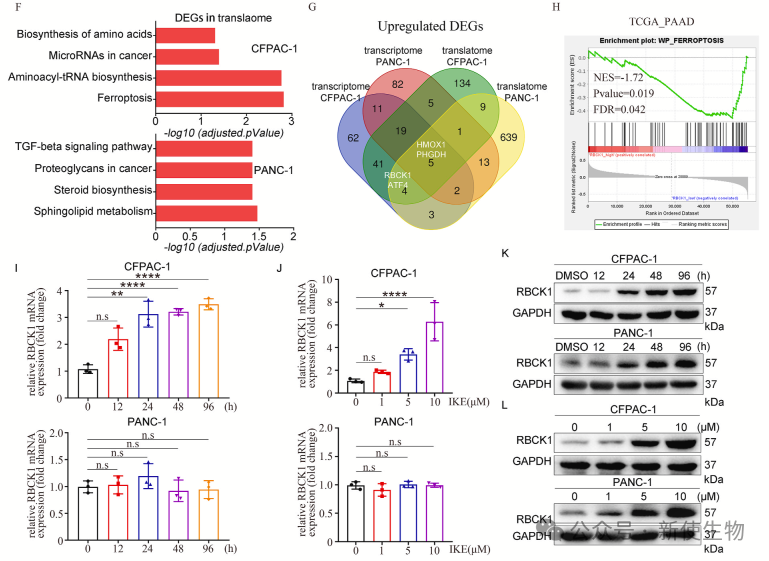
三. RBCK1是PDAC中一种新的铁死亡抑制因子
作者的研究发现,RBCK1是PDAC中的一个新型铁死亡抑制因子。RBCK1在PDAC细胞中被上调,其耗竭或抑制会增强铁死亡诱导的细胞死亡和脂质过氧化,表明RBCK1可能通过抑制铁死亡来促进PDAC的发展。
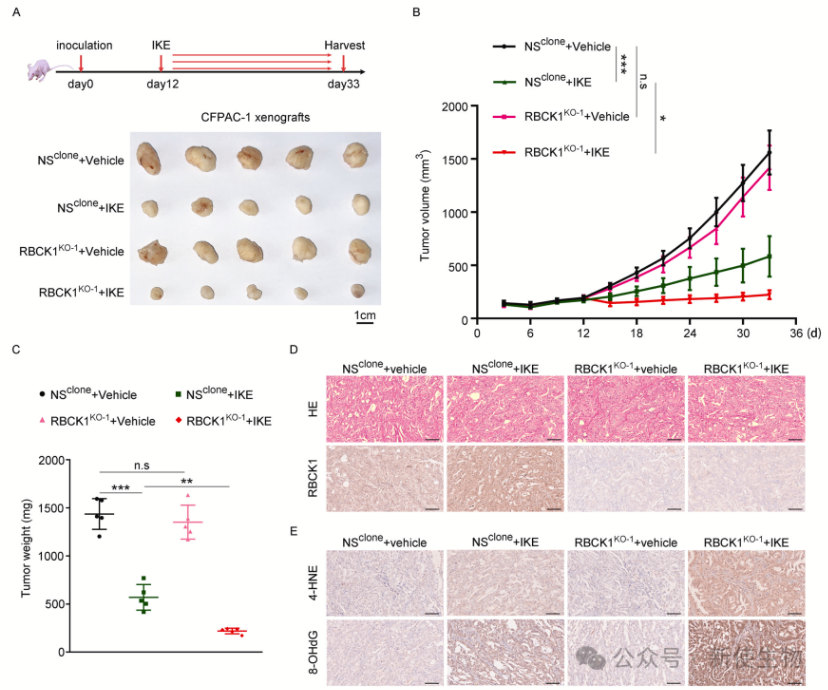
四. RBCK1在体内抑制IKE的抗癌活性
在体内实验中,RBCK1缺失的CFPAC-1细胞对IKE更敏感,表现为肿瘤生长延迟和重量减少。IKE处理提高了肿瘤中的RBCK1表达,同时在RBCK1缺失的肿瘤中观察到更高的脂质过氧化和DNA/RNA氧化损伤水平,这表明RBCK1在体内抑制铁死亡。
五. RBCK1与MFN2相互作用,促进其K48连接多泛素化
为了研究RBCK1介导的铁死亡抑制机制,作者分析了铁死亡驱动因子与RBCK1底物的交集,发现MFN2是RBCK1的潜在底物。
尤其是在IKE处理下,RBCK1促进了MFN2的K48连接泛素化。此外,RBCK1的RING-IBR-RING域中的四个保守半胱氨酸对其E3连接酶活性至关重要,这些突变会抑制RBCK1介导的MFN2泛素化。这表明RBCK1通过促进MFN2的K48连接泛素化来抑制铁死亡。
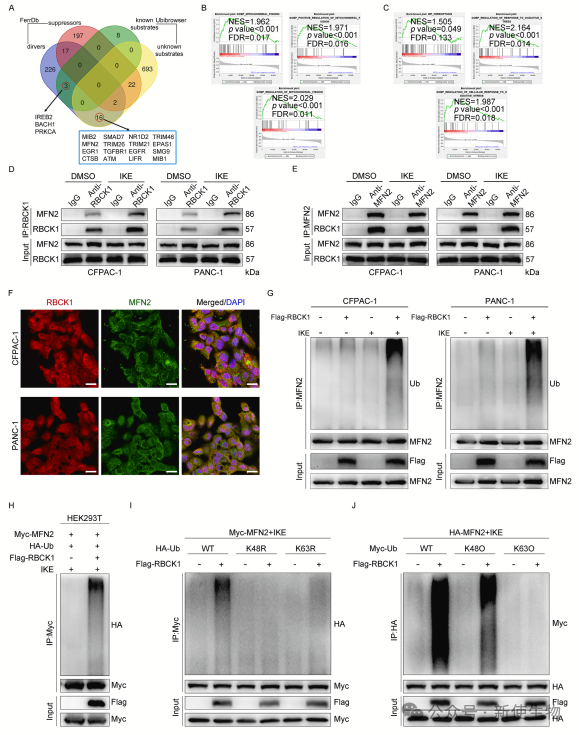
六. RBCK1通过铁死亡诱导下的不稳定化作用,破坏MFN2稳定性
RBCK1通过促进K48连接的泛素化,导致MFN2的降解。在铁死亡诱导下RBCK1使MFN2蛋白水平降低,且其半衰期缩短。这一降解作用依赖于蛋白酶体系统,RBCK1缺失能够恢复MFN2的蛋白水平。

七. MFN2是RBCK1在铁死亡调控中的下游效应基因
RBCK1缺失导致MFN2介导的线粒体融合和mtROS增加,而MFN2缺失则逆转这些效应。RBCK1缺失增强了IKE诱导的脂质过氧化,MFN2缺失则抑制这一过程。
体内实验显示,RBCK1缺失使肿瘤对IKE更敏感,而MFN2缺失则阻止了这种效应,表明MFN2是RBCK1调控铁死亡的关键效应基因。

八. RBCK1-MFN2轴在胰腺导管腺癌中的临床意义
为了解RBCK1-MFN2轴在胰腺导管腺癌中的临床意义,作者分析了公共数据集中的表达情况。
结果显示,RBCK1在PDAC组织中显著上调,而MFN2虽然mRNA水平升高,但其蛋白质水平在PDAC中却下调。RBCK1和MFN2的蛋白丰度在PDAC组织中呈负相关。
生存分析表明,RBCK1高表达与患者整体生存期缩短相关,而MFN2高丰度则与生存期延长相关。这些结果表明RBCK1-MFN2轴可能参与了PDAC的进展。

总结
本文发现铁死亡激活剂IKE在PDAC细胞中诱导E3泛素连接酶RBCK1的上调。RBCK1的缺失使PDAC细胞对铁死亡更加敏感。在RBCK1通过与线粒体调节因子MFN2相互作用并促进其泛素化降解,从而减少线粒体ROS产生和脂质过氧化,表明RBCK1-MFN2轴可能成为治疗PDAC的潜在靶点。
新使生物NeoRibo推出国内首款超高分辨率翻译组Ribo-seq建库试剂盒。我们的Ribo-seq核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可联系杭州新使生物科技有限公司
感谢关注新使生物,核糖体分析可以联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们