导读
胃癌(GC)是全球第五大常见癌症和第三大癌症相关死亡原因,揭示胃癌的分子机制并探索个性化治疗十分重要。
N6-甲基腺苷(m6A)是mRNA中的常见修饰,调控因子的失调(如METTL3、FTO、YTHDF、hnRNPA2B1等)会影响RNA处理和翻译。其中,调控因子hnRNPA2B1在RNA合成和处理中的作用包括与m6A修饰的前mRNA相互作用,但其在胃癌中的具体作用仍不清楚。
幽门螺杆菌(H. pylori)是胃癌的主要风险因素,可通过激活NF-κB等信号通路促进癌细胞生长和转移。然而,幽门螺杆菌是否通过hnRNPA2B1介导胃癌的机制尚不明确。
mRNA翻译是支撑所有细胞活动和功能的重要生物过程。翻译失调导致特定蛋白质的过度产生和癌症进展。
已有报道poly(A)结合蛋白1(PABPC1)与eIF4F复合物相互作用,促进mRNA的环化和帽依赖翻译,稳定mRNA,并整合调控信号。这些翻译过程对于癌细胞生长和生存中涉及的蛋白质的准确和高效合成至关重要。
2024年6月17日,上海市第六人民医院消化内科张靖团队在Advanced Science上发表了一篇题为“Helicobacter Pylori-Enhanced hnRNPA2B1 Coordinates with PABPC1 to Promote Non-m6A Translation and Gastric Cancer Progression”的论文,发现了幽门螺杆菌增强hnRNPA2B1与PABPC1协同以促进非m6A翻译,并推动胃癌的发生,揭示hnRNPA2B1可能是胃癌的预后因子和潜在治疗靶点。

文章索引
【发表日期】2024年6月17日
【IF】15.1
研究结果
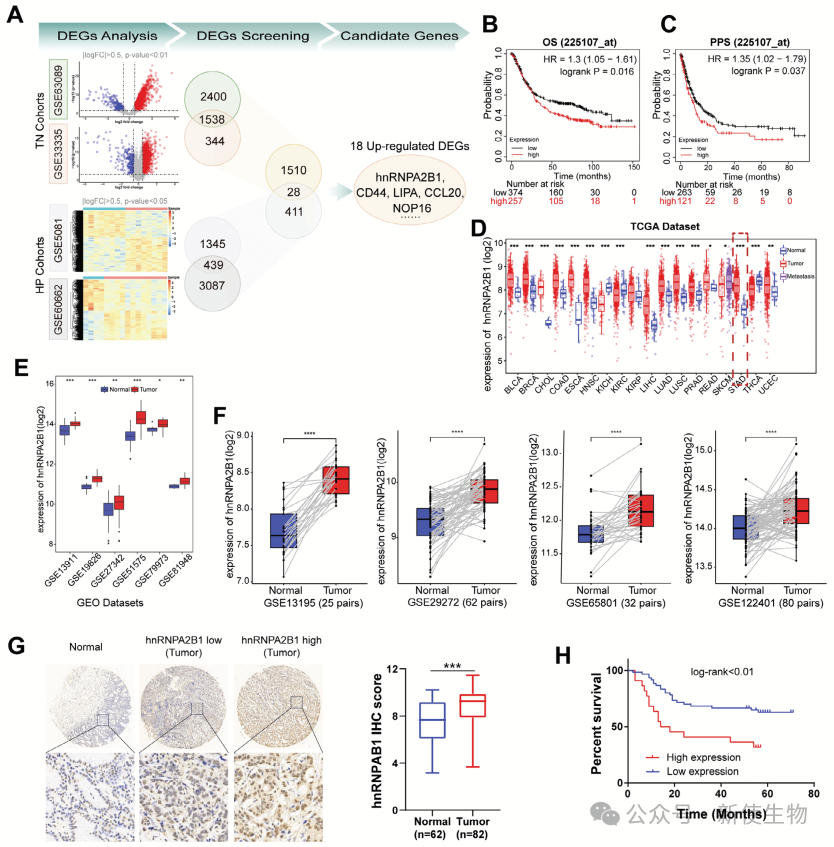
一. hnRNPA2B1在胃癌患者中上调,并与不良预后相关
在对GEO数据库的综合分析中,作者确定了与胃癌相关的关键差异表达基因(DEGs),尤其是与幽门螺杆菌感染密切相关的基因。
通过交叉分析,发现了28个基因,其中hnRNPA2B1在胃癌中显著上调。进一步分析显示,hnRNPA2B1的高表达与胃癌患者较差的总体生存率和进展后生存率相关。
通过分析多个数据库和临床样本,作者确认了hnRNPA2B1的高表达与胃癌不良预后相关。
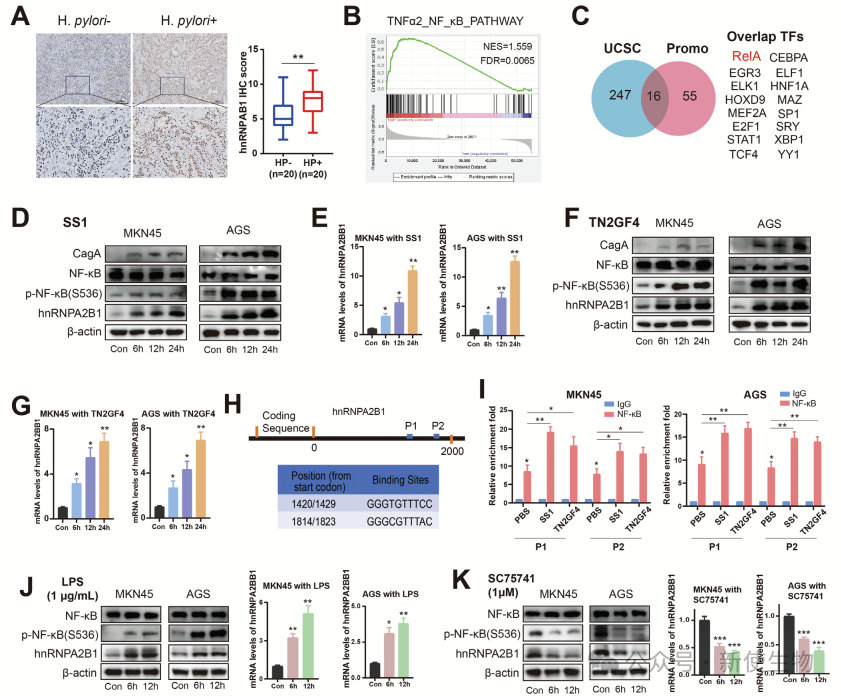
二. 幽门螺杆菌 (H. pylori) 通过诱导NF-𝜿B至hnRNPA2B1启动子区域,促进其表达上调
研究发现幽门螺杆菌感染会显著上调hnRNPA2B1的表达,且这一过程通过NF-𝜅B信号通路调控。作者使用NF-𝜅B激活剂LPS和抑制剂SC75741的实验进一步确认了NF-𝜅B对hnRNPA2B1转录的调控作用。
三. hnRNPA2B1在幽门螺杆菌感染下调节胃癌中的代谢变化
为了了解hnRNPA2B1在胃癌中的作用,作者通过TCGA数据分析发现hnRNPA2B1参与了细胞周期和代谢重编程等过程。幽门螺杆菌感染通过hnRNPA2B1影响肿瘤代谢,增加了葡萄糖摄取及乳酸和丙酮酸的产生,同时降低了NADP+/NADPH比率。
临床数据表明,hnRNPA2B1的表达与肿瘤的糖酵解代谢指标SUVmax相关,这表明hnRNPA2B1能调节幽门螺杆菌感染引起的胃癌代谢变化。

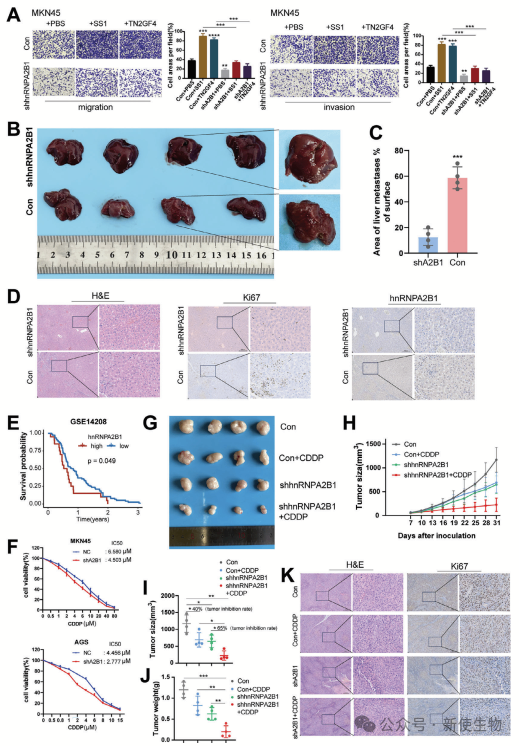
四. hnRNPA2B1的缺失限制胃癌转移并提高对顺铂化疗的敏感性
hnRNPA2B1缺失显著减少了幽门螺杆菌诱导的胃癌细胞迁移和侵袭,并在小鼠模型中降低了肝转移面积。
除此之外,高表达hnRNPA2B1的胃癌患者对顺铂化疗反应较差,而hnRNPA2B1缺失提高了胃癌细胞对顺铂的敏感性。hnRNPA2B1缺失组在顺铂治疗后的肿瘤生长抑制率为65%,高于对照组的40%,表明hnRNPA2B1可能是提升化疗效果的潜在靶点。
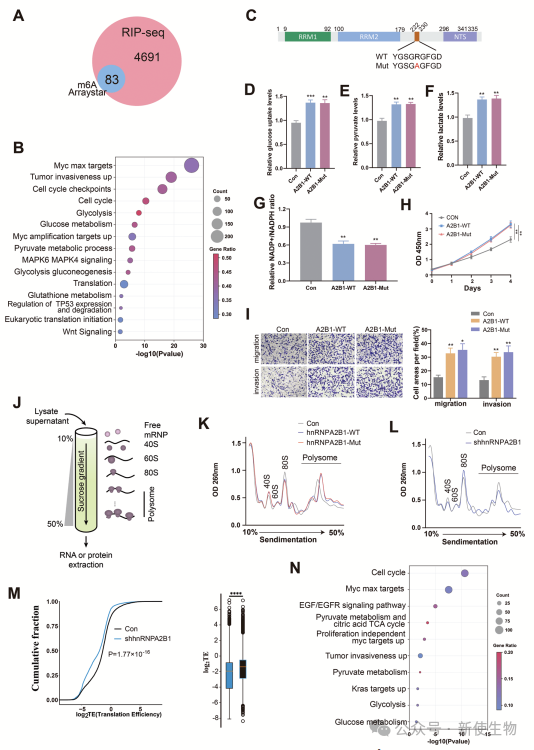
五. hnRNPA2B1作为癌基因在不依赖于m6A修饰的情况下增强mRNA翻译
研究发现hnRNPA2B1主要调控不含m6A修饰的mRNA,而不是通过m6A修饰。hnRNPA2B1与m6A修饰的转录本仅有少量重叠(不到2%),表明其主要通过m6A非依赖机制调控癌细胞中的mRNA。
引入m6A催化点突变的hnRNPA2B1仍能促进糖酵解、细胞增殖、迁移和侵袭,证明其作为癌基因的作用不依赖于m6A修饰。
通过Polysome profiling多聚核糖体分析证实hnRNPA2B1诱导翻译活性上调,独立于m6A修饰。
作者利用Ribo-seq核糖体印迹分析和RNA-seq表明,与对照组相比,hnRNPA2B1 KD在胃癌细胞中的翻译效率明显降低。总之,hnRNPA2B1能通过增加多聚核糖体的翻译活性来增强mRNA翻译,并且这一作用与m6A修饰无关。
六. hnRNPA2B1与PABPC1-eIF4F复合体相互作用,促进胃癌细胞中的非m6A翻译
研究发现,hnRNPA2B1通过与PABPC1-eIF4F复合体相互作用,促进胃癌细胞中的mRNA翻译。
进一步研究揭示,hnRNPA2B1还与eIF4F复合体相互作用,促进翻译起始。PABPC1与hnRNPA2B1的相互作用对于翻译过程至关重要,敲低PABPC1或hnRNPA2B1都削弱了它们之间的结合。
恢复hnRNPA2B1(无论是WT还是m6A催化无活性形式)能有效促进PABPC1与eIF4F复合体的结合,突显了hnRNPA2B1在胃癌细胞翻译调控中的关键作用。
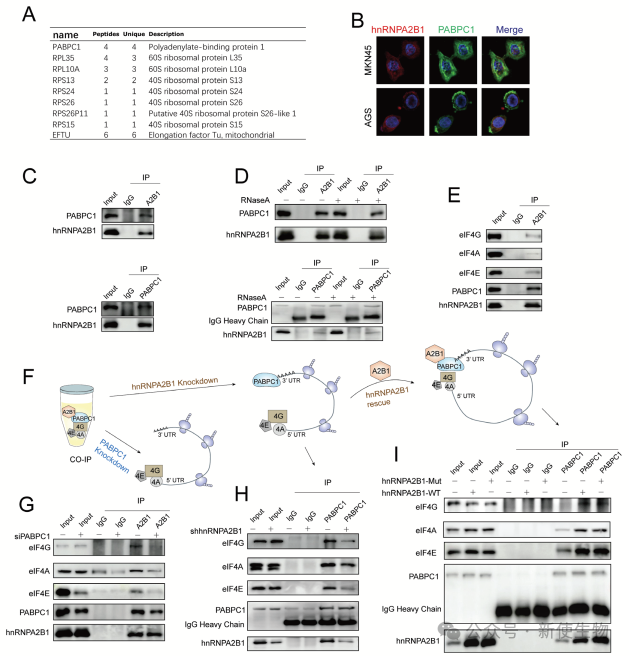
七. hnRNPA2B1-PABPC1复合体促进胃癌中表观遗传因子的非m6A翻译
作者通过Ribo-seq核糖体印迹分析识别了482个在翻译中被hnRNPA2B1和PABPC1共同激活的转录本。作者选择了未被m6A修饰的mRNAs(如CIP2A、DLAT、GPX1),并发现这些转录本与hnRNPA2B1和PABPC1结合。过表达hnRNPA2B1或PABPC1增加了这些蛋白的水平,而其敲降则减少了这些蛋白的水平。
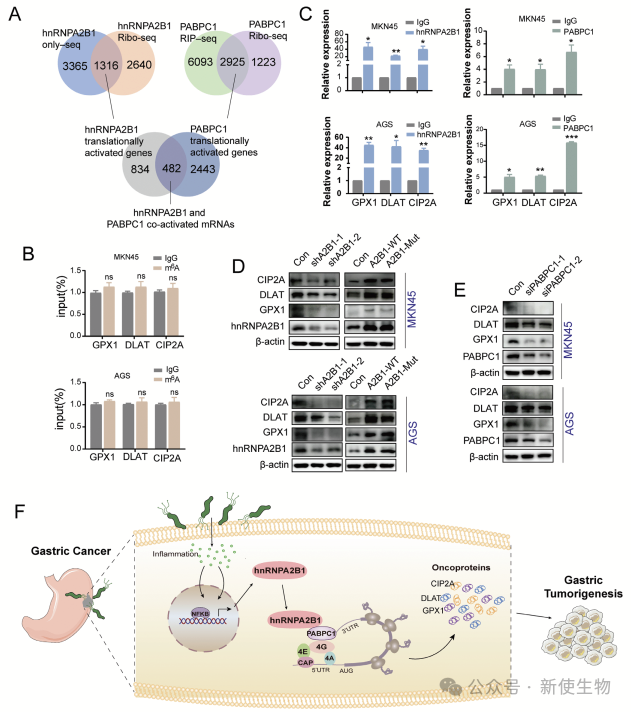
总结
研究表明,hnRNPA2B1在幽门螺杆菌相关胃癌中上调,并与不良预后相关。幽门螺杆菌通过招募NF-κB来促进hnRNPA2B1的表达。hnRNPA2B1通过与PABPC1和eIF4F复合体相互作用,增强CIP2A、DLAT和GPX1的非m6A翻译,推动胃癌进展。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可联系杭州新使生物有限公司



 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们