导读
基因编辑的核心在于确保临床安全并避免基因毒性。多种方法已用于评估编辑工具的脱靶效应,并已开发了高保真CRISPR系统。除单核苷酸变异外,结构变异(如大缺失、易位)也成为临床关注重点。
研究显示:
A)CRISPR/Cas9可在小鼠及人类细胞中引发大缺失和染色体丢失,且相关染色体异常与p53激活及细胞死亡相关。
B)碱基编辑器(BEs)能在不引发双链断裂(DSBs)的情况下转换碱基对,但其脱氨酶结构域会导致DNA和RNA层面的脱靶单核苷酸变异(SNVs)。
C)此外,胞嘧啶脱氨酶可触发DSBs,引发DNA断裂和染色体不稳定。
近期研究表明,CGBE会造成双链断裂及结构变异,但对ABE相关副作用的评估尚不充分。
2024年11月11日,中国科学院脑科学与智能技术卓越创新中心孙怡迪、周昌阳与深圳农业基因组研究所左二伟团队合作在Genome Biology上发表了一篇题为“Adenine base editors induce off-target structure variations in mouse embryos and primary human T cells”的论文,利用全基因组测序评估了CRISPR/Cas9、ABE和CBE在小鼠胚胎中的脱靶结构变异,结果显示这些基因编辑工具在小鼠胚胎及人类细胞中均频繁引发结构变异。

文章索引
【发表日期】2024年11月11日
【IF】17.9
研究结果
一. CRISPR/Cas9及碱基编辑器引发结构变异的全基因组检测
本研究使用GOTI方法结合全基因组测序,发现Cas9和ABE在小鼠胚胎中引发大量脱靶结构变异(SVs),包括大规模缺失和染色体易位,ABE导致的缺失更大且断点富含TAT基序。
脱靶SVs影响基因表达,且多为sgRNA非依赖性。单细胞RNA测序验证了ABE在人体细胞中也会引发类似缺失。
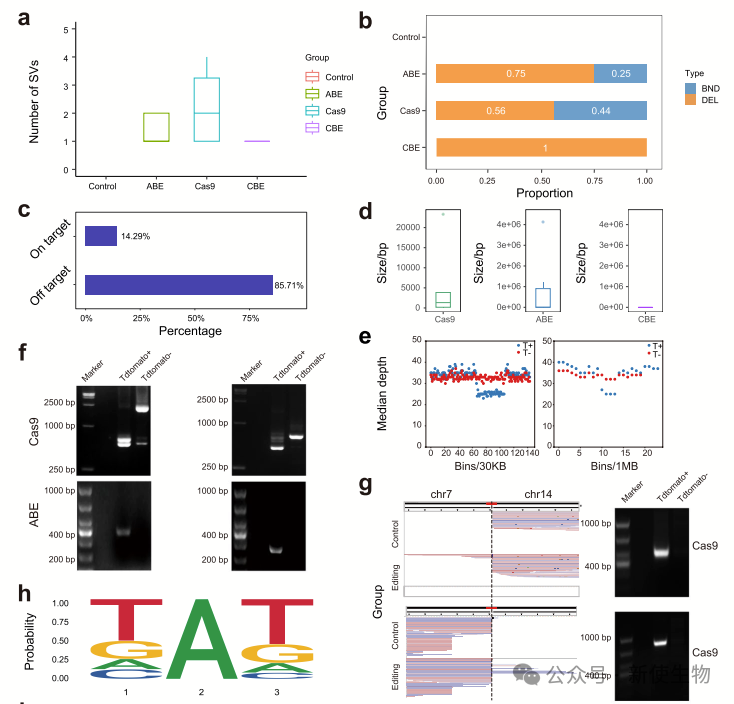
二. 单细胞RNA测序分析揭示CRISPR/Cas9或ABE切割后人初级T细胞中染色体非整倍性
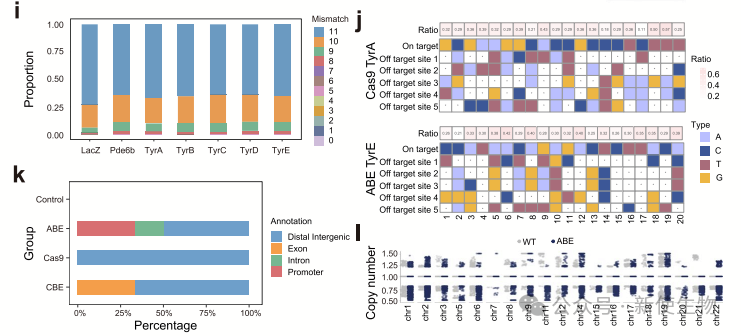
作者分析了CRISPR/Cas9和ABE8.8在T细胞中的非靶向结构变异。结果表明,Cas9处理的T细胞中约32.74%为非整倍体,ABE处理的为9.17%,且除了靶点外还发现染色体缺失,提示基因编辑可能引发基因组变化,影响临床应用安全性。
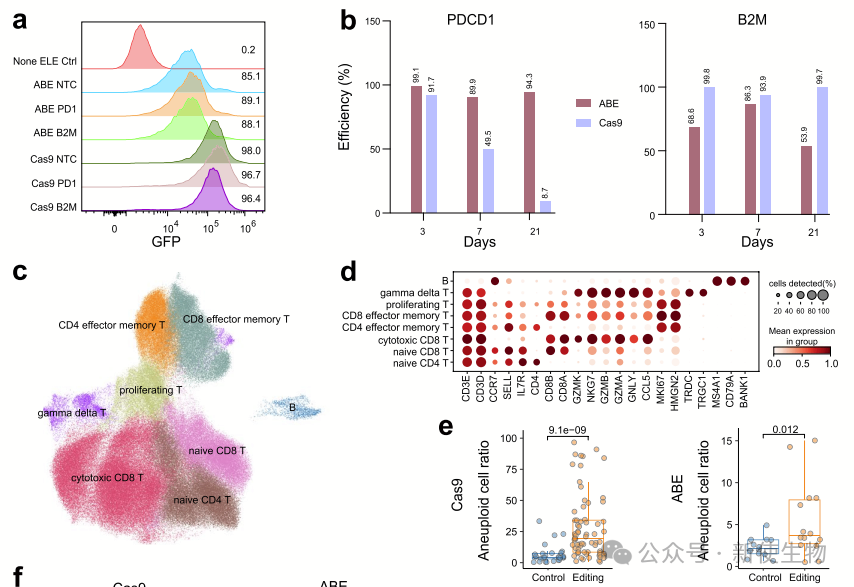
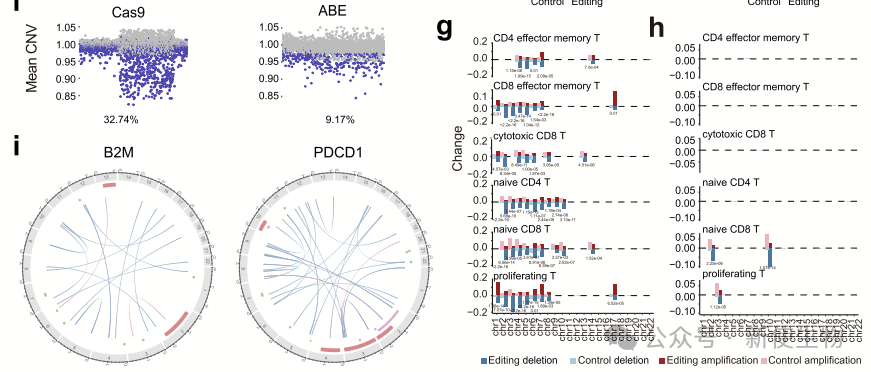
大多数非整倍体细胞仅在单个染色体上存在缺失,Cas9处理的PDCD1靶向细胞中多个染色体缺失的比例较高。Cas9和ABE处理的非整倍体细胞显著上调了与细胞增殖、癌症进展和p53通路相关的基因。
ABE处理的细胞周期相关基因显著上调,且非整倍体细胞在细胞周期早期阶段的比例增加。
总体而言,Cas9和ABE靶向PDCD1和B2M时,均检测到与功能性基因相关的染色体缺失。
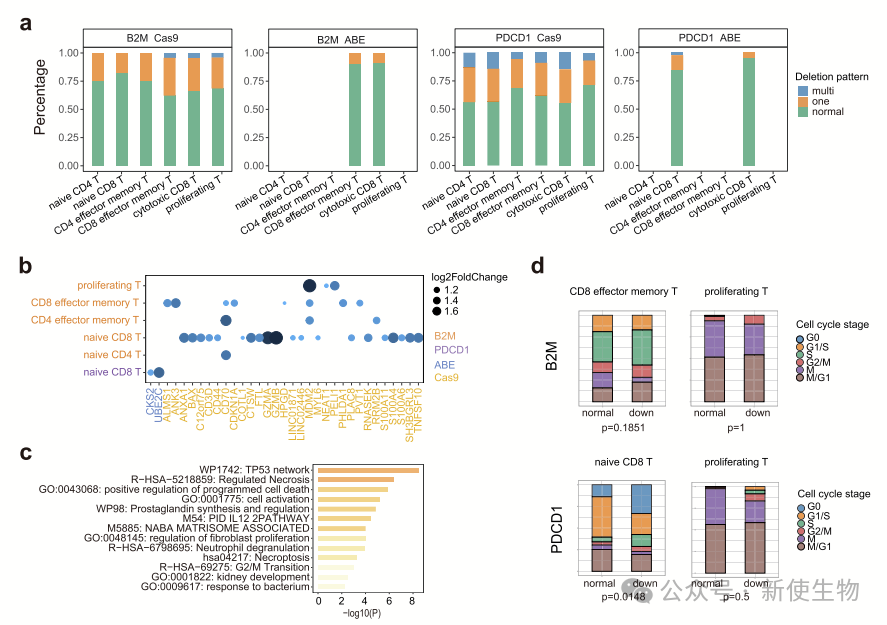
Cas9和ABE诱导的非整倍体细胞比例随时间逐渐下降,但长期存活的非整倍体细胞表达与细胞周期、DNA修复和损伤相关的基因,提示其在临床治疗中的潜在安全风险。
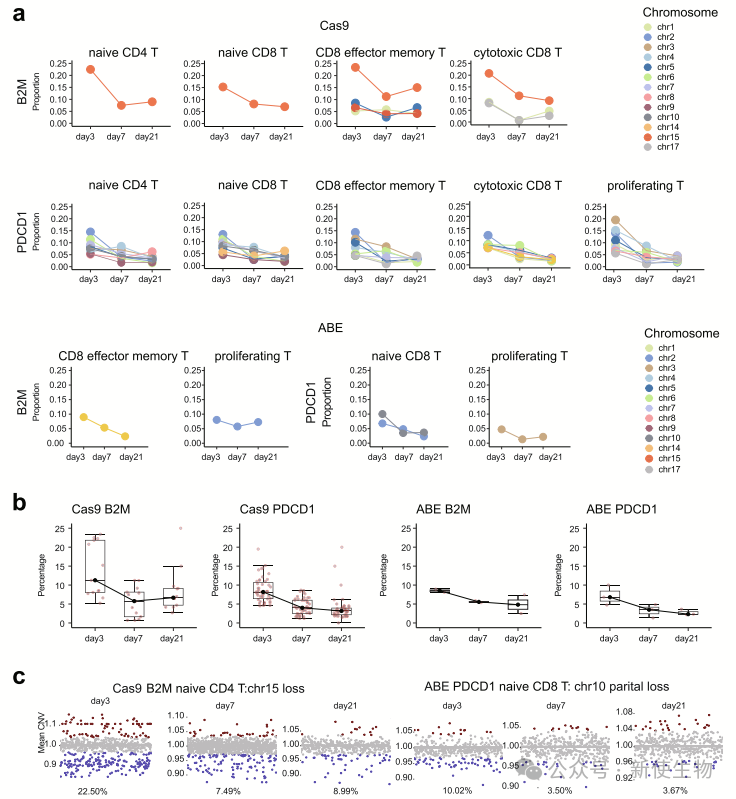
三. 不同细胞类型中的染色体非整倍性
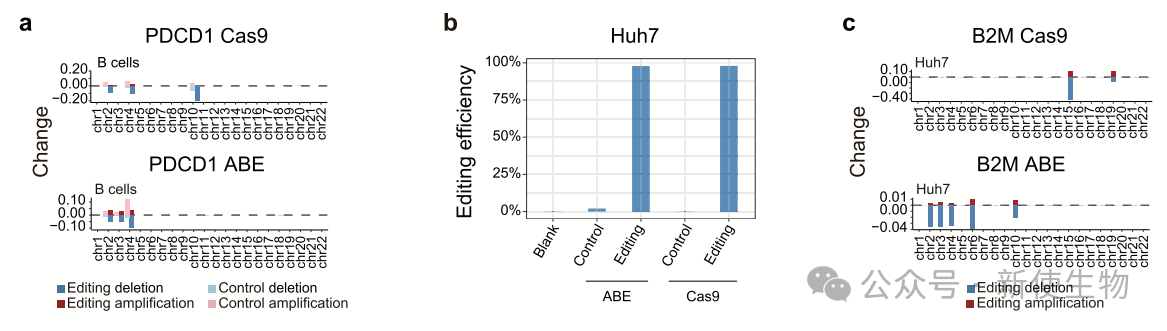
为了验证ABE引起的结构变异是否特异于T细胞,作者还在B细胞和Huh7细胞中进行了编辑。
结果表明,ABE和Cas9处理的B细胞和Huh7细胞中均检测到脱靶SV,且染色体非整倍性细胞比例显著高于对照组,这表明脱靶SV不仅仅存在于T细胞,也普遍存在于其他细胞类型中。
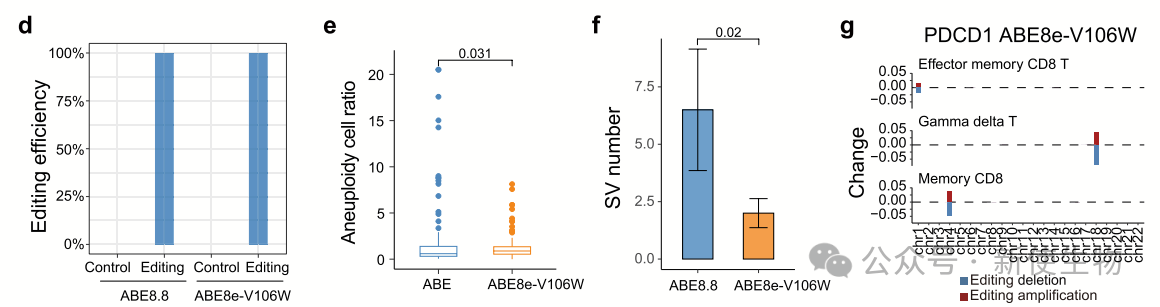
四. 高保真ABE处理的原代T细胞中的脱靶结构变异
使用高保真ABE(ABE8e-V106W)处理原代T细胞靶向PDCD1时,编辑效率与传统ABE相似,且脱靶单倍体细胞比例和脱靶SV数量显著减少。
这表明SV是由脱氨酶有关,而与sgRNA无关,并可以通过高保真ABE版本减少SV。
总结
本研究探讨了Cas9、ABE和CBE在小鼠胚胎和人类T细胞中的脱靶结构变异(SVs)。结果表明,Cas9和ABE会引发脱靶SVs,而CBE较少。Cas9引发的单倍体细胞激活P53和凋亡通路,ABE则使细胞停滞在G0期。高保真ABE显著减少了SVs,提示大家需要开发更高保真的基因编辑工具。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可联系杭州新使生物有限公司


感谢关注新使生物,核糖体分析可以联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们