导读
癌基因mRNA编码的蛋白剂量严格受控,以维持正常细胞稳态,而癌细胞则依赖高水平的癌基因蛋白以促进生长和生存。其中,Myc作为关键转录因子,在癌症中需维持高表达,对肿瘤发生至关重要,但其转录后调控机制仍不清楚。
5′ UTR介导的转录本特异性翻译控制可能是调节Myc表达的关键。尽管5′ UTR含有调控序列,其翻译仍可能受RNA结合蛋白(RBP)的调控。癌细胞表达1500多种RBP,这些蛋白受癌基因信号调控,并可能通过调节RNA结构精准控制癌基因表达,影响癌细胞功能。
Myc是胰腺导管腺癌(PDAC)的核心驱动因子,在42%的PDAC中高表达,与侵袭性和不良预后相关,并促进PDAC对治疗的抗性。因此,解析Myc翻译的选择性调控机制将拓展PDAC研究,并为Myc依赖型癌症提供新的治疗策略。
2025年2月4日,美国加州大学旧金山分校Davide Ruggero团队在Nature Cell Biology上发表了一篇题为“Functional screen identifies RBM42 as a mediator of oncogenic mRNA translation specificity”的论文,强调了翻译控制的多层特异性及其在Myc依赖性肿瘤发生中的体内作用,阐明了癌细胞对癌基因蛋白合成的依赖性如何依靠5′ UTR RNA结构的重塑。

文章索引
【发表日期】2025年2月4日
【IF】28.21
研究结果
一. MYC翻译的选择性调控因子网络
作者通过全基因组CRISPRi筛选识别了多个选择性调控MYC翻译的因子,发现UBAP2L、METTL3、YTHDF2和RBM42等RBP在调控MYC翻译中起关键作用。
它们通过影响MYC mRNA翻译过程,而非转录水平来调控Myc蛋白的表达,为癌症治疗提供了新的潜在靶点。
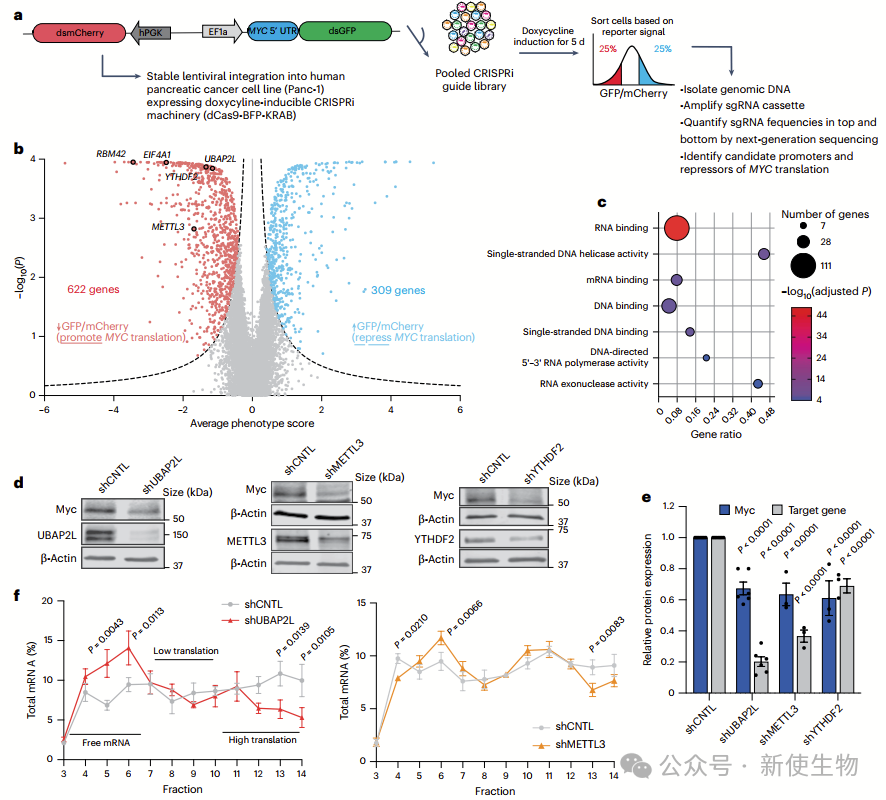
二. RBM42是MYC翻译的调控因子
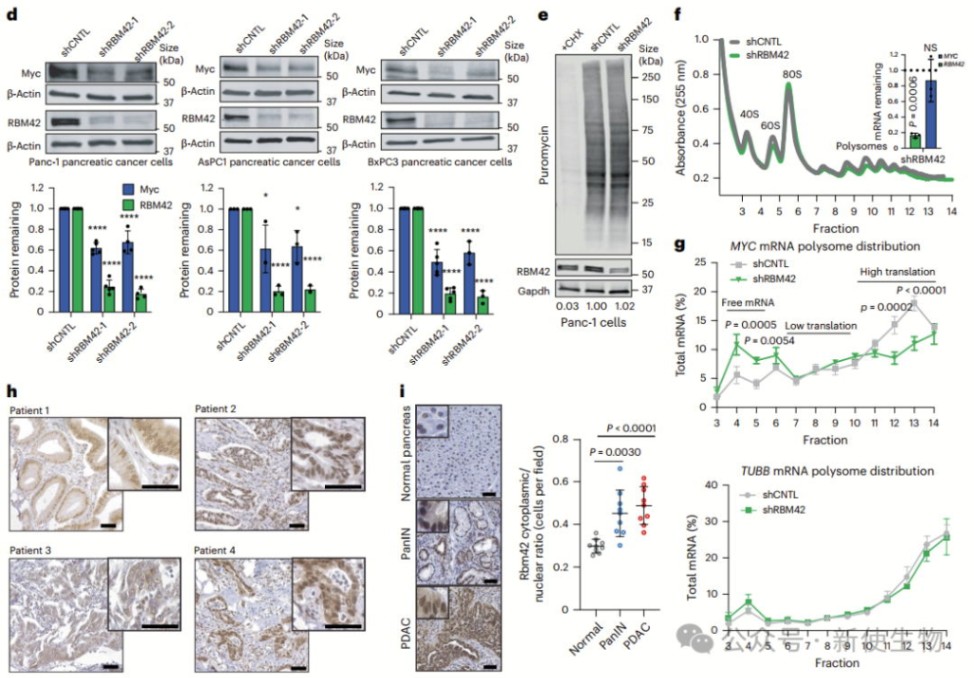
作者发现RBM42能通过促进MYC mRNA的选择性翻译,增加Myc蛋白的表达,且不影响MYC mRNA水平或稳定性。
Polysome profiling多聚核糖体分析显示RBM42缺失不会改变全局蛋白合成,但选择性减少了MYC翻译。
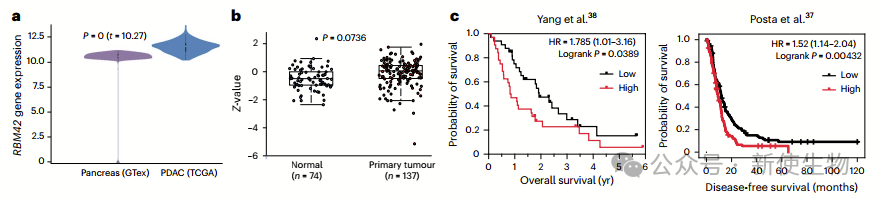
免疫组织化学显示,RBM42在胰腺癌组织中主要定位于细胞质,并在肿瘤早期阶段显著增加,这些结果表明RBM42在胰腺癌中通过调控MYC翻译维持Myc蛋白水平。
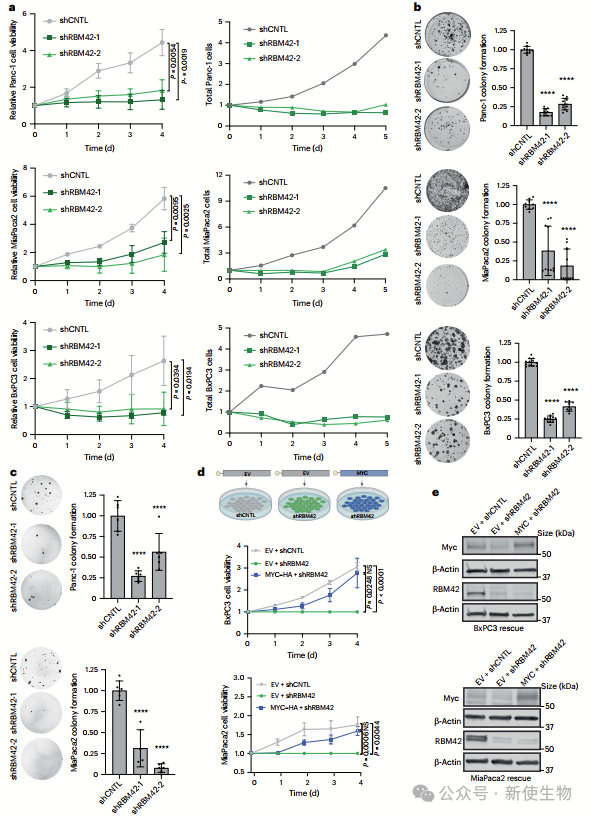
三. RBM42通过Myc对胰腺导管腺癌(PDAC)细胞的生存至关重要
RBM42的缺失导致PDAC细胞生长和存活显著下降。通过去除5′ UTR的Myc表达能恢复RBM42缺失引起的细胞存活下降,表明RBM42通过调控Myc维持PDAC细胞生存。
四. RBM42调控癌基因翻译程序
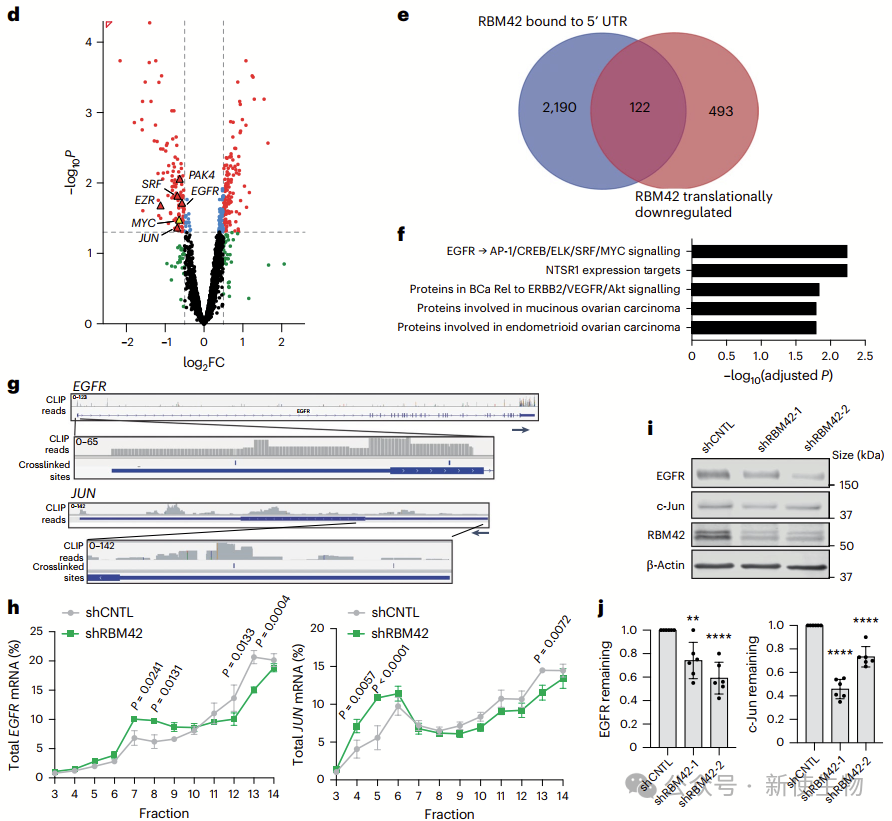
通过CLIP-seq分析,作者发现RBM42直接结合MYC mRNA的5′ UTR,并在细胞质中显著富集,提示其可能调控MYC翻译。
进一步的Polysome profiling多聚核糖体分析和Ribo-seq核糖体印迹分析显示,RBM42结合并促进翻译的基因包括EGFR、c-Jun等癌基因,它们在RBM42耗减后翻译效率降低。
此外,RBM42对其他癌症相关基因的翻译也有调控作用,支持其在胰腺癌中作为翻译调控因子的功能。
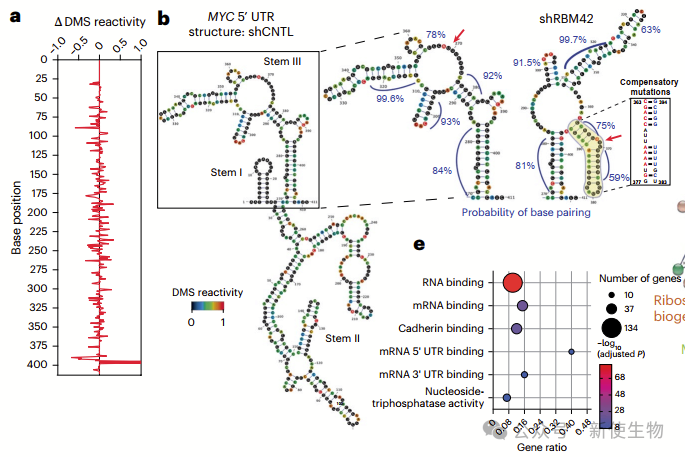
五. RBM42重塑MYC 5′ UTR结构调控翻译
作者通过DMS-seq发现RBM42结合在MYC 5′ UTR的Stem III区域,改变了该区域的结构,使其更有利于翻译起始。去除RBM42后,MYC 5′ UTR的结构变得更封闭,导致翻译效率下降。
删除发夹序列后可以恢复翻译效率,表明RBM42通过重塑MYC 5′ UTR结构,促进翻译并维持Myc蛋白水平。
六. RBM42与43S翻译起始复合物(PIC)相互作用
研究表明,RBM42与翻译起始复合物(43S PIC)相互作用,促进其招募到MYC mRNA上,从而增强翻译起始。
Polysome profiling多聚核糖体分析显示RBM42通过直接与40S核糖体亚基和翻译因子eIF2β结合,调节MYC翻译。RBM42缺失会减少48S PIC在MYC mRNA上的组装,但对控制mRNA无影响。
这些结果表明RBM42在PDAC细胞中通过调控MYC的翻译起始,维持Myc蛋白的表达水平。

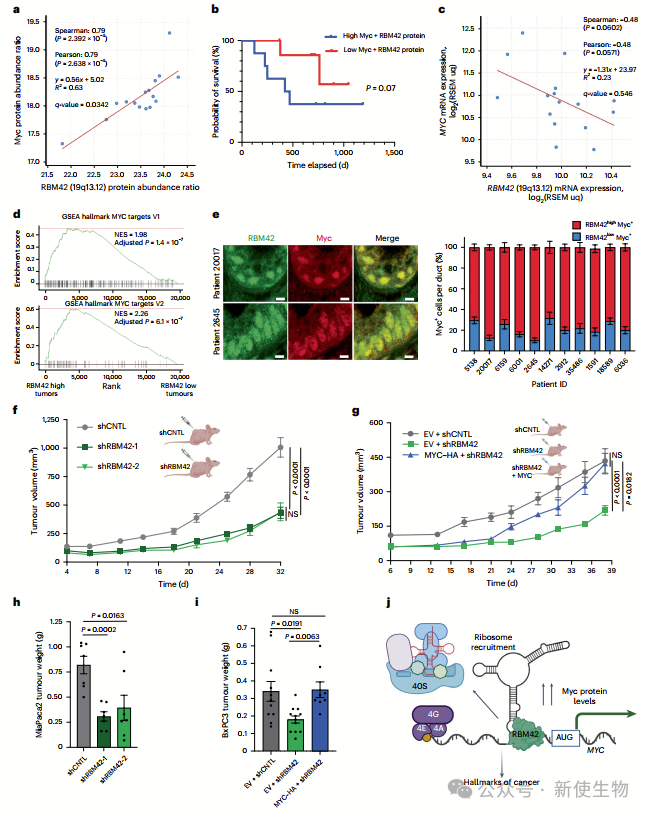
七. RBM42通过Myc调控体内肿瘤发生
作者发现RBM42与Myc蛋白水平显著相关,且在胰腺导管腺癌(PDAC)中与Myc转录活性相关。RBM42通过翻译调控机制维持Myc蛋白的高水平,从而促进肿瘤生长。
在PDAC小鼠模型中,RBM42缺失导致肿瘤生长受抑制,而强制表达Myc可恢复肿瘤生长,表明RBM42主要通过调控Myc蛋白翻译发挥其致癌作用。
总结
本研究发现RBM42通过重塑MYC的5′非翻译区结构,促进MYC及其他致癌转录本的翻译,进而驱动胰腺导管腺癌的发生。RBM42在PDAC中高表达,且与较差预后相关,其作用依赖于MYC。此发现为癌症翻译控制提供了新的理解,并揭示了靶向致癌基因表达的治疗机会。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
