tRNA在蛋白质合成中作为氨基酸与遗传密码的桥梁,具有超过100种RNA修饰。后生动物的tRNA平均含有约13种修饰,但这些修饰分布不均,有些普遍存在,有些则较为罕见。
ac⁴C(RNA胞嘧啶乙酰化)是一种高度保守的修饰,广泛存在于所有生物域。ac⁴C由NAT10酶转录后修饰RNA,并通过适配因子Thumpd1在tRNA中形成。Thumpd1在酿酒酵母和裂殖酵母中对tRNASer和tRNALeu的ac⁴C形成至关重要。
ac⁴C缺失会导致tRNA水平下降、生长缺陷以及一般氨基酸控制途径的激活。罕见的THUMPD1突变与tRNA中ac⁴C的丧失及神经发育缺陷相关,尽管已知RNA修饰位点数量增加,但对这些修饰的生理影响仍缺乏深入分析。

文章索引
【发表日期】2025年3月19日
【IF】14.95
研究结果
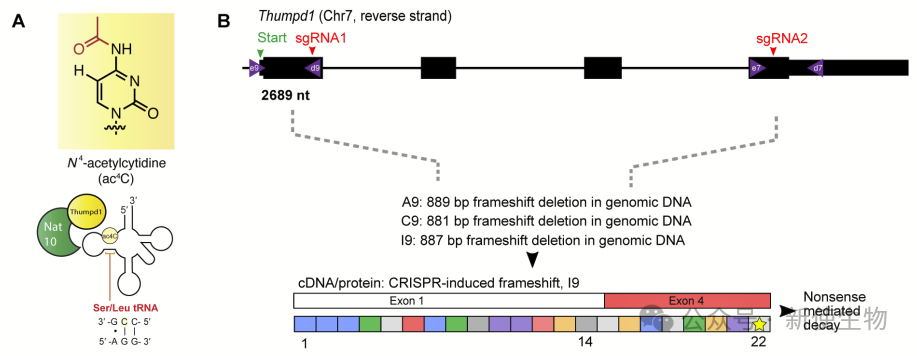
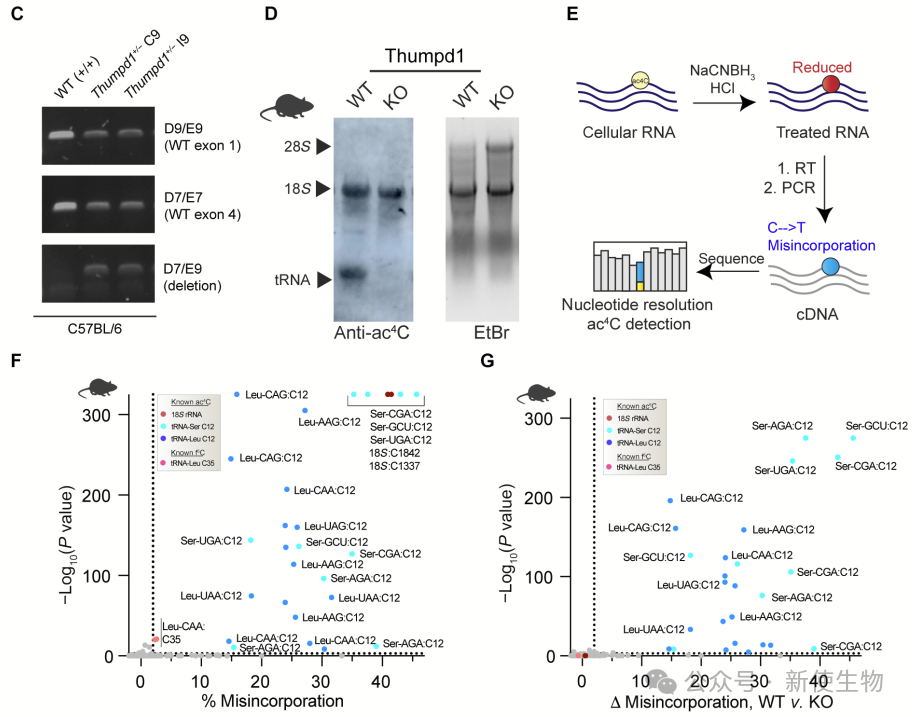
作者利用CRISPR-Cas9构建Thumpd1⁺/⁻杂合敲除小鼠,并确认Thumpd1缺失导致tRNA乙酰化(ac⁴C)丧失。
通过ac⁴C-seq分析WT和KO小鼠肝脏tRNA,他们发现ac⁴C修饰主要出现在tRNASer和tRNALeu的D臂C12位点,遍及所有同功型,且依赖Thumpd1。
该修饰在酵母、小鼠和人类中高度保守,进一步证实Thumpd1在tRNA乙酰化中的关键作用。
二. Thumpd1缺失导致小鼠体型变小且不育
Thumpd1⁻/⁻小鼠体型变小且不育,出生比例低于孟德尔预期。KO小鼠卵巢和睾丸萎缩,生殖细胞凋亡增加,且无法生育,但存活无神经缺陷,表明Thumpd1在生长和生殖中至关重要。

三. THUMPD1调控tRNALeu的整体水平及其核糖体占有率
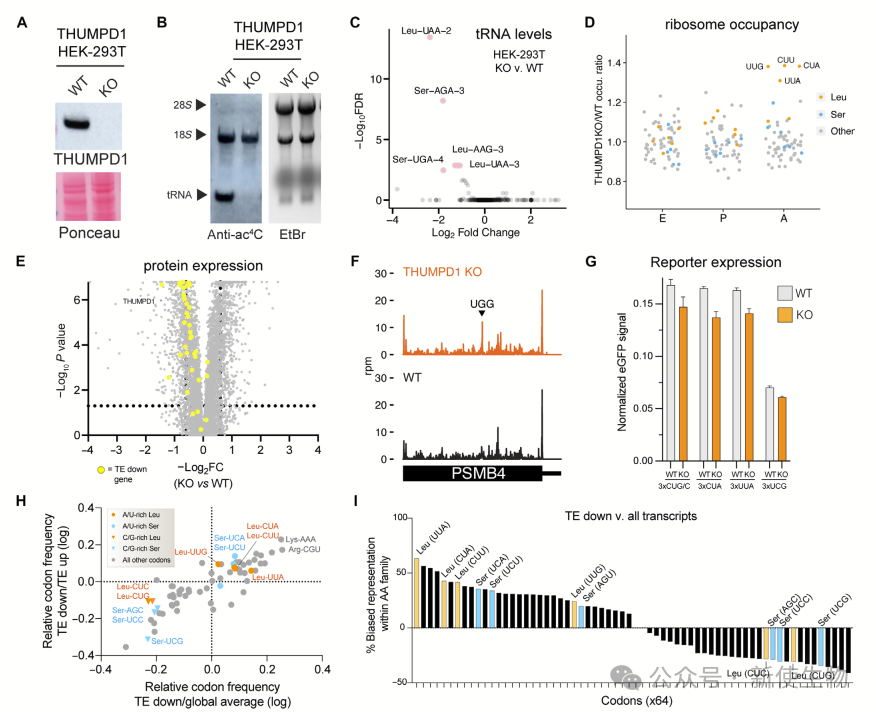
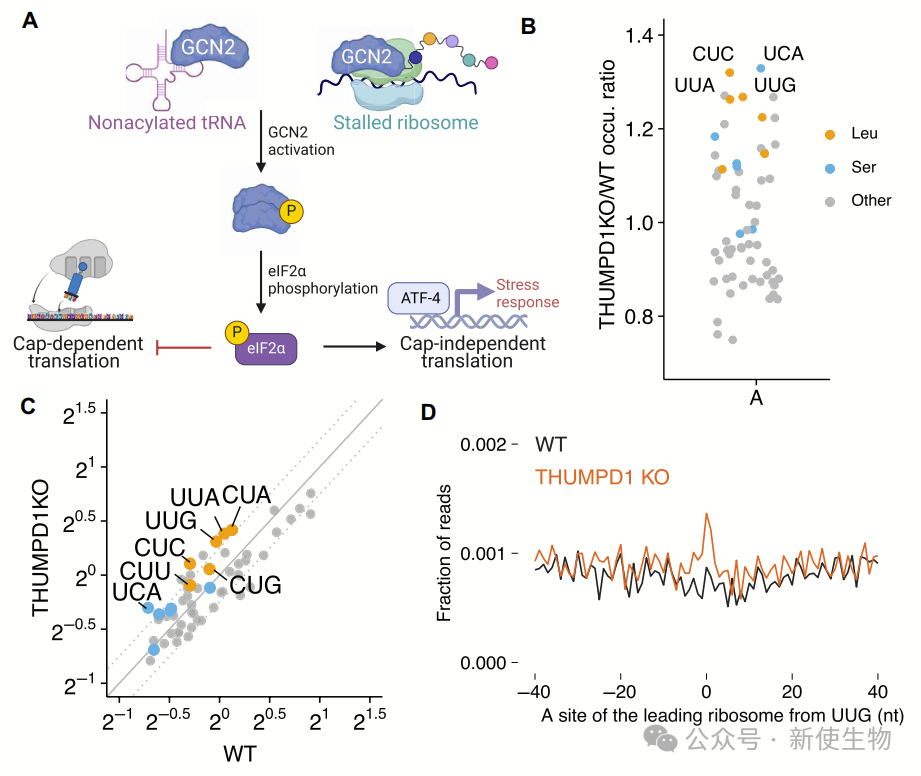
mim-tRNA-seq分析显示,THUMPD1 KO细胞中ac⁴C修饰的tRNA水平显著下降,尤其是tRNALeuUAA-2,同时伴随核糖体A位点Leu密码子(UUG、CUA、CUU、UUA)停滞增加。尽管 THUMPD1 依赖的核糖体停滞主要影响Leu相关密码子,tRNASer则变化不显著。
蛋白组学和Ribo-seq核糖体印迹分析的翻译效率(TE)结果表明,U/A富集的Leu相关密码子(UUG、CUA、CUU、UUA)在TE降低的mRNA中显著富集,但这一影响不足以明显干扰报告基因表达或完全解释THUMPD1缺失导致的蛋白质组重塑。
这些结果揭示了THUMPD1通过tRNA乙酰化调控Leu密码子翻译的复杂机制。
四. THUMPD1缺失刺激eIF2α的磷酸化
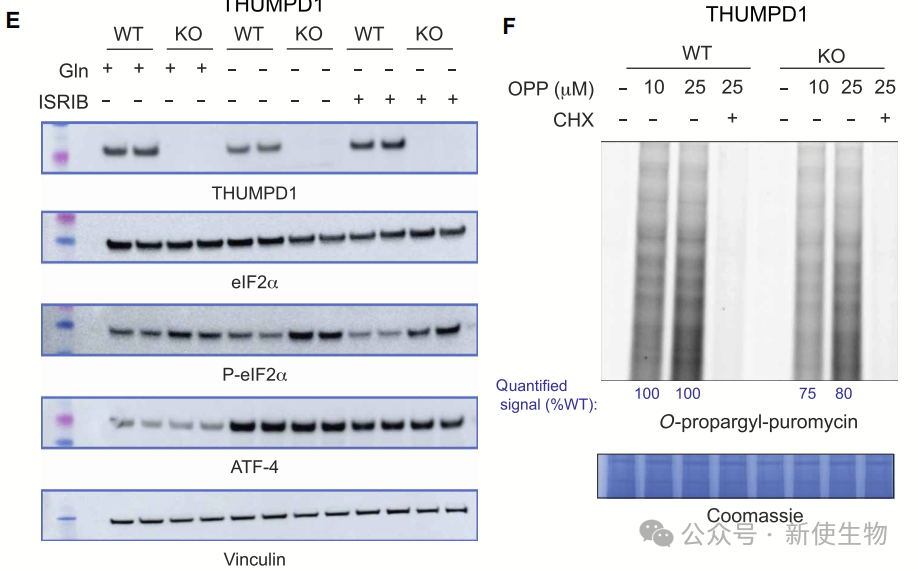
THUMPD1缺失通过增加核糖体碰撞和eIF2α磷酸化,导致翻译受损。Disome-seq双核糖体印迹分析显示尽管tRNASer和tRNALeu的氨基酸化未显著下降,THUMPD1 KO细胞中仍出现核糖体在特定密码子上的占据增加,特别是在Leu和Ser密码子上。
eIF2α磷酸化的增加与翻译下降相关,并且THUMPD1 KO细胞显示出较低的OPP标记水平和核糖体蛋白减少。
这些结果表明THUMPD1缺失可能通过影响核糖体功能和翻译效率,调控细胞蛋白合成。
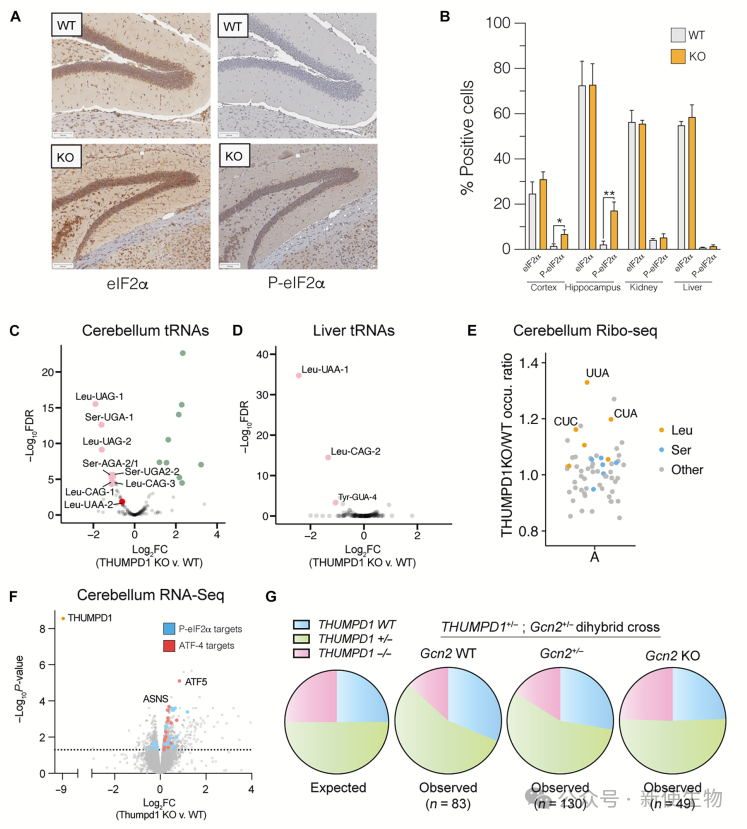
五. Thumpd1在体内与Gcn2基因相互作用
Thumpd1 KO小鼠大脑中P-eIF2α增多,小脑和肝脏中的tRNASer和tRNALeu下调。RNA-seq分析显示eIF2α磷酸化增加,激活ISR通路。
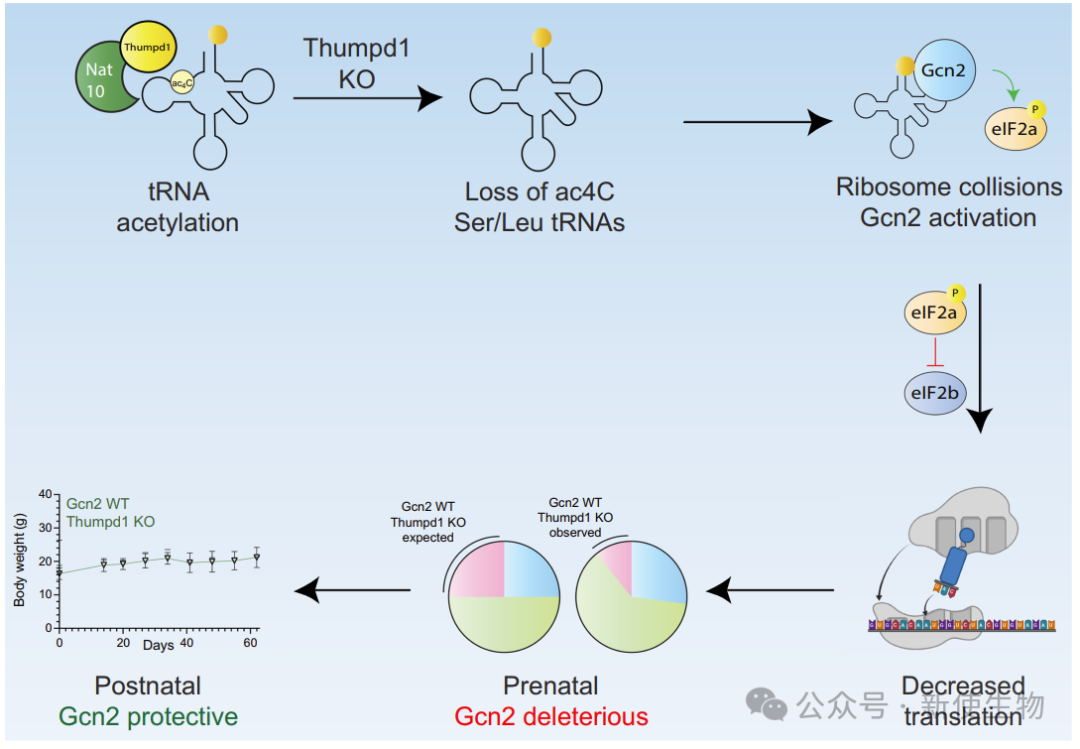
Thumpd1与Gcn2的遗传相互作用表明,Gcn2缺失改善Thumpd1 KO小鼠的产前适应,但出生后导致早期致死,伴随加重的病理表现。
总结
本研究探讨了tRNA修饰ac⁴C的生理作用。靶向Thumpd1发现tRNA乙酰化丧失会导致tRNALeu水平下降、核糖体停滞和eIF2α磷酸化的激活。Thumpd1敲除小鼠表现出生长缺陷和不育,与Gcn2共敲除导致小鼠出生后致死。研究表明,ac⁴C修饰通过调控核糖体应激信号在哺乳动物中发挥作用。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
