阿尔茨海默病(AD)是一种伴有记忆衰退、认知功能障碍、Aβ斑块沉积和神经炎症的神经退行性疾病。神经炎症,特别是小胶质细胞的过度激活,是AD的重要驱动因素。尽管针对Aβ的疗法有一定效果,但副作用较大,且靶向神经炎症的药物研发仍处于早期阶段。
PKR是炎症通路中的关键分子,其耗减可改善AD小鼠模型中的突触和学习缺陷。目前PKR的小分子抑制剂存在副作用,迫切需要更安全的抑制剂。
研究表明,环状RNA(ds-cRNA)可以抑制PKR活化,且合成ds-cRNA免疫原性低,能够通过脂质纳米颗粒递送并改善银屑病表型,显示出其在AD治疗中的潜力。

文章索引
【IF】46.9
研究结果
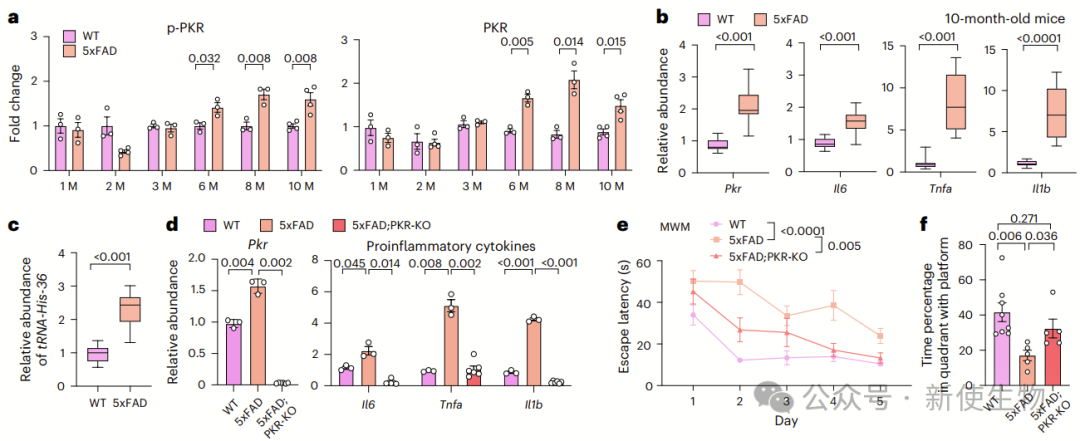
研究发现,AD小鼠模型5xFAD的海马区PKR及p-PKR水平随年龄升高,并伴随促炎细胞因子上调和circRNA可能减少。PKR敲除(PKR-KO)可显著降低神经炎症,并改善5xFAD小鼠的空间记忆能力。
此外,EMCV感染诱导PKR激活可加速Aβ聚集,而PKR-KO可阻止这一过程。
这些结果表明,PKR过度激活促进AD病程,其抑制可作为潜在治疗策略。
研究表明,尽管小分子PKR抑制剂C16能够缓解5xFAD小鼠的神经炎症,但其副作用限制了疗效和长期使用。相比之下,ds-cRNAs通过抑制PKR二聚化有效减少PKR激活,降低促炎细胞因子和Aβ斑块,且毒性较低。
作者通过AAV递送ds-cRNAs至海马区,成功改善了AD小鼠的神经炎症和认知功能,显示出比C16更优的安全性和疗效。
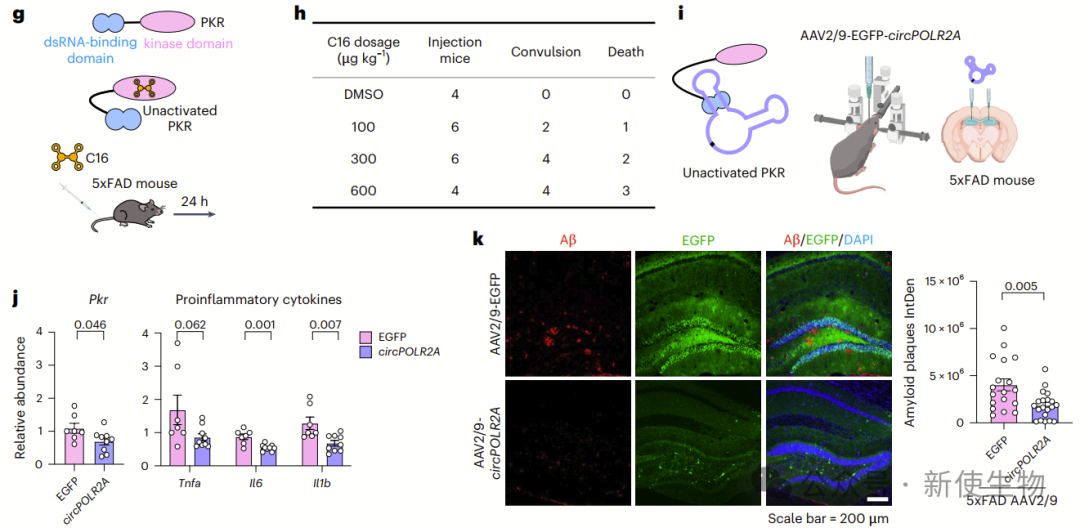
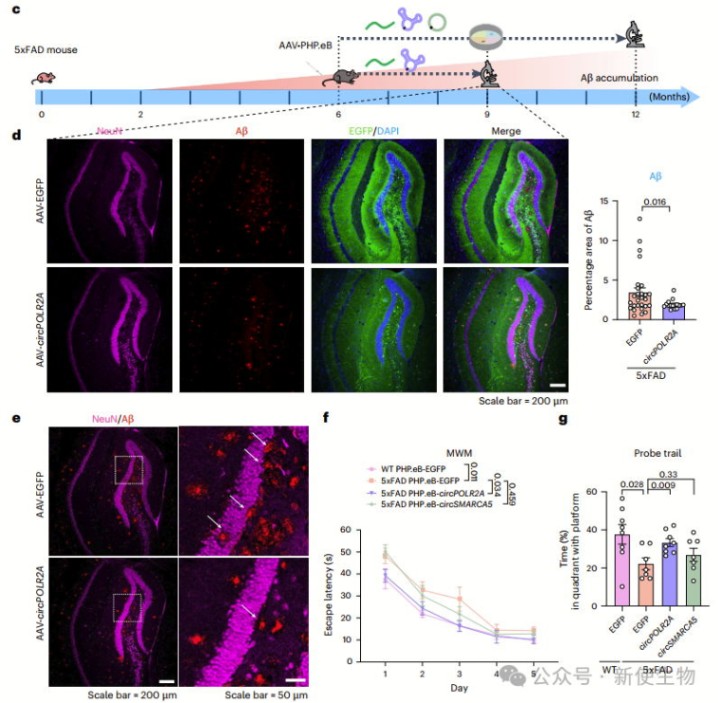
作者发现AAV递送的ds-cRNA能够有效抑制PKR激活,减轻AD小鼠的Aβ斑块积累、Tau蛋白聚集、神经炎症,并改善空间学习和记忆能力。
这一疗法较小分子PKR抑制剂具有更好的疗效和较低的毒性,体现治疗AD的潜力。
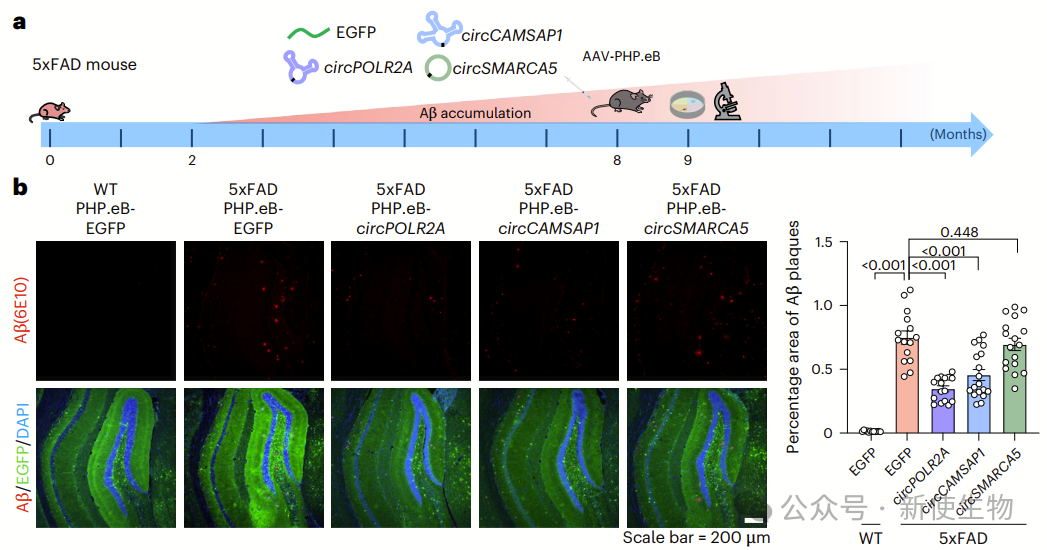
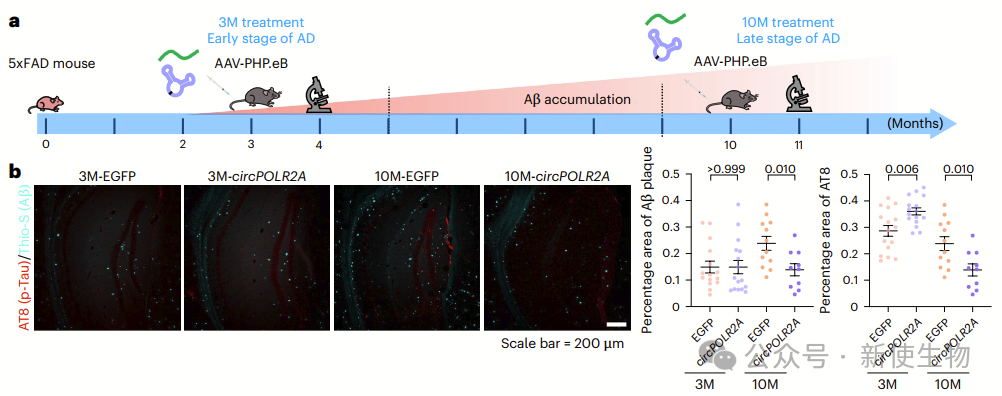
在早期(3个月)和晚期(10个月)5xFAD小鼠中,ds-cRNA治疗的效果不同。
早期治疗未见Aβ斑块减少,但显著抑制了胶质细胞增殖,而晚期治疗显著减少了Aβ斑块、Tau磷酸化、神经元丧失和胶质细胞增殖,改善了认知功能。
6个月后,AAV介导的ds-cRNA治疗仍能有效减少Aβ斑块、磷酸化Tau和胶质增殖,并提升空间学习与记忆能力,表明治疗至少能持续6个月。
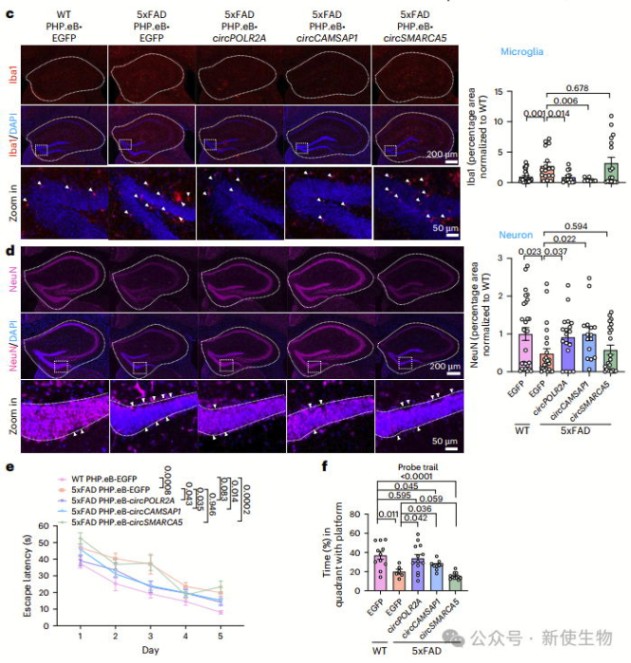
AAV载体传递的双链环状RNA(ds-cRNA)通过抑制神经元和小胶质细胞中的PKR激活,减轻了阿尔茨海默病的相关表型。
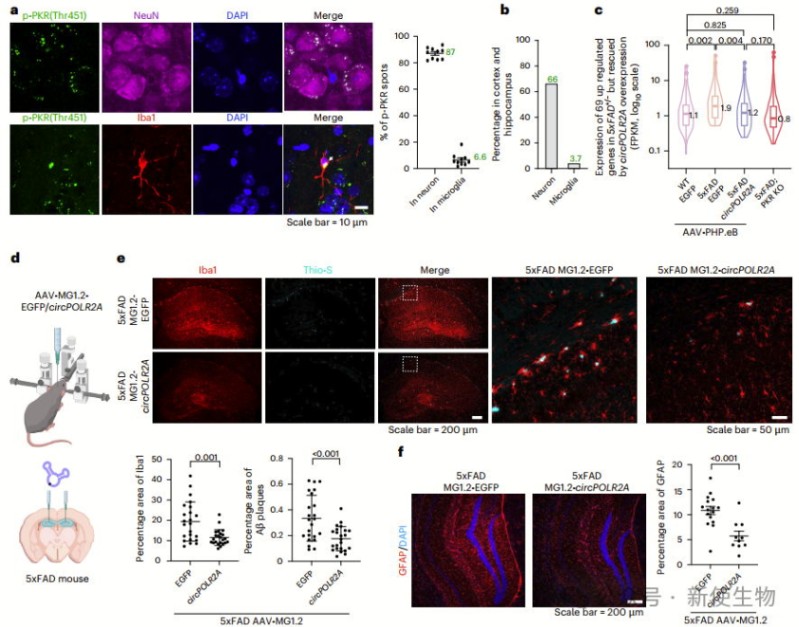
免疫荧光分析显示,大部分PKR激活发生在神经元中,小胶质细胞也有一定比例的PKR激活。通过RNA测序比较,ds-cRNA治疗组显示出显著减少了与免疫反应相关的基因表达,表明ds-cRNA可以通过抑制PKR激活缓解AD的病理特征。
此外,ds-cRNA治疗也减少了小胶质细胞的增殖和Aβ斑块的积累,改善了学习和记忆功能。因此,作者认为ds-cRNA作为一种靶向PKR激活的治疗策略,具有潜力缓解AD的进展和神经炎症。
本研究通过环状RNA靶向阿尔茨海默病小鼠模型中的PKR,成功抑制过度的PKR活性,减少神经炎症和淀粉样β斑块,且毒性较低。通过静脉注射AAV-PHP.eB,将ds-cRNAs输送至全脑,实现神经保护,并改善空间学习和记忆能力。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
