神经肌肉接头(NMJ)是下运动神经元与骨骼肌之间的末端突触连接。在哺乳动物中,每个NMJ最终仅由一条运动轴突支配,该特异性连接通过围产期的发育性突触消除实现,在小鼠中发生于出生后前两周。类似的修剪机制也存在于中枢神经系统,对建立功能性神经网络至关重要。
尽管研究者已经了解NMJ突触消除的细胞机制,但调控多余输入修整的分子机制仍不清楚。已有如TNF-α等调节因子被发现,但整体驱动机制尚未明确。
一个可能的关键机制是运动神经元中翻译的细胞类型特异性调控。例如,抑制肌纤维中的蛋白合成可诱导突触消除,而树突和轴突中的局部翻译也被证实在突触修饰和神经回路建立中发挥作用。相比转录组,翻译组学(translatomics)可以更准确反映蛋白表达情况,提供新的研究视角。

文章索引
【发表日期】2025年4月15日
【IF】6.7
研究结果
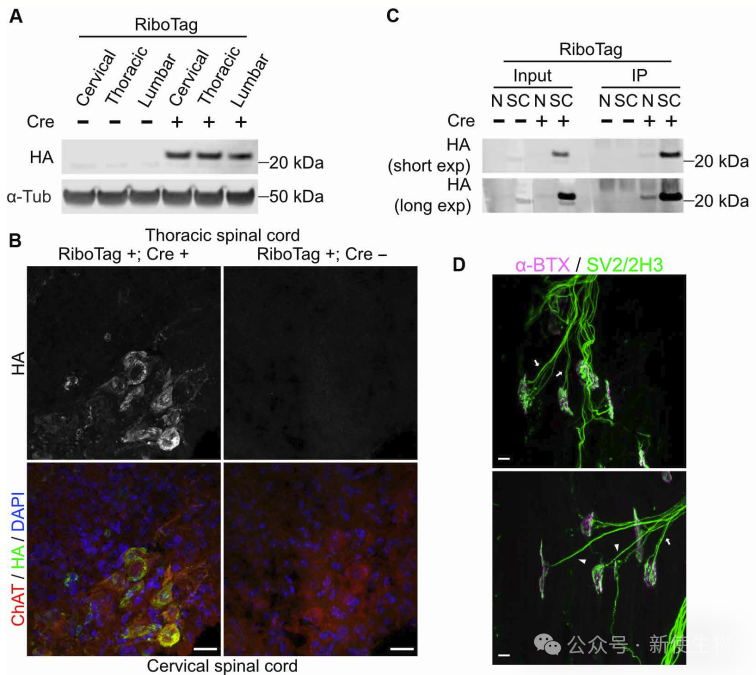
为了研究突触消除期间运动神经元的翻译情况,作者使用ChAT-RiboTag小鼠模型,特异性在胆碱能神经元中表达RPL22-HA,并通过TRAP技术分离核糖体结合mRNA。
实验确认RPL22-HA仅在携带Cre的小鼠脊髓中表达,定位于运动神经元胞体及轴突。
功能分析表明,RPL22-HA的表达不影响P10时神经肌肉接头(NMJ)的正常突触消除过程,验证了该模型用于体内运动神经元翻译组研究的可行性。

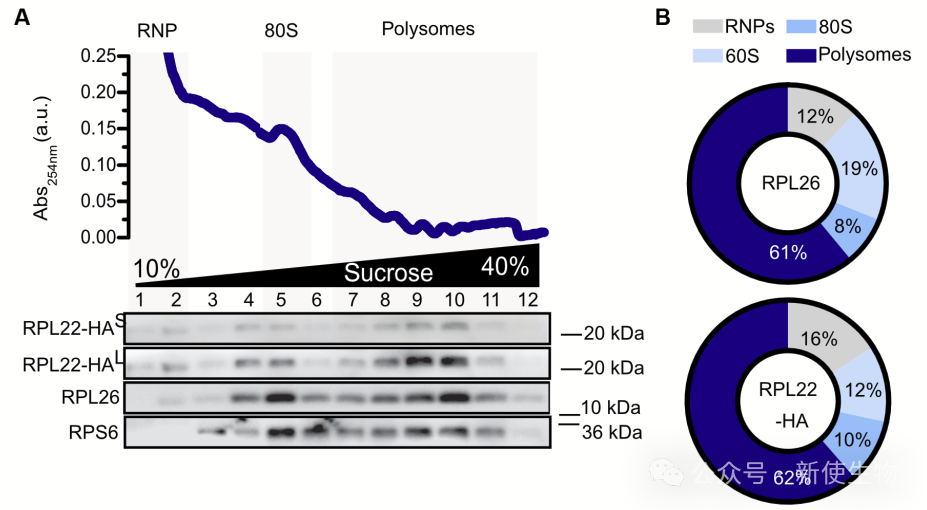
研究表明,ChAT-RiboTag小鼠中表达的RPL22-HA能够整合进活跃翻译的核糖体。
通过Polysome profiling多聚核糖体分析,作者发现RPL22-HA与核糖体大亚基和多聚核糖体组分共沉降,证明其参与翻译过程。
利用TRAP技术,研究者从脊髓中成功分离出高质量的运动神经元翻译mRNA,验证了该方法的有效性。
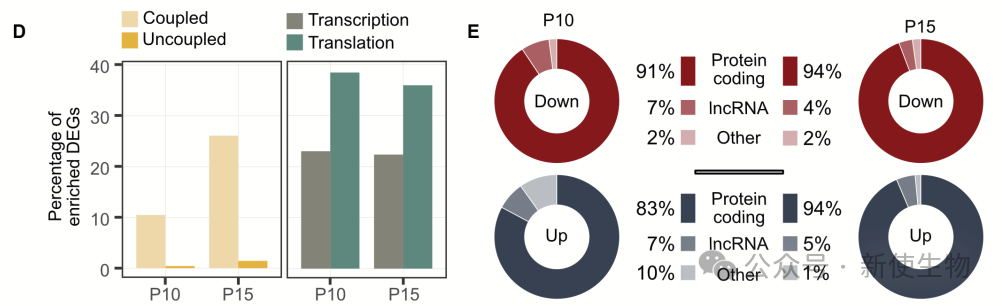
作者发现,运动神经元翻译组在突触消除过程中经历了显著变化,主要由翻译水平的变化驱动,而非转录水平的变化。
P15时,差异表达基因数量和变化强度较P10和P5更为显著,这些基因大多数为蛋白编码基因(>90%),长非编码RNA和其他非编码基因所占比例较小。

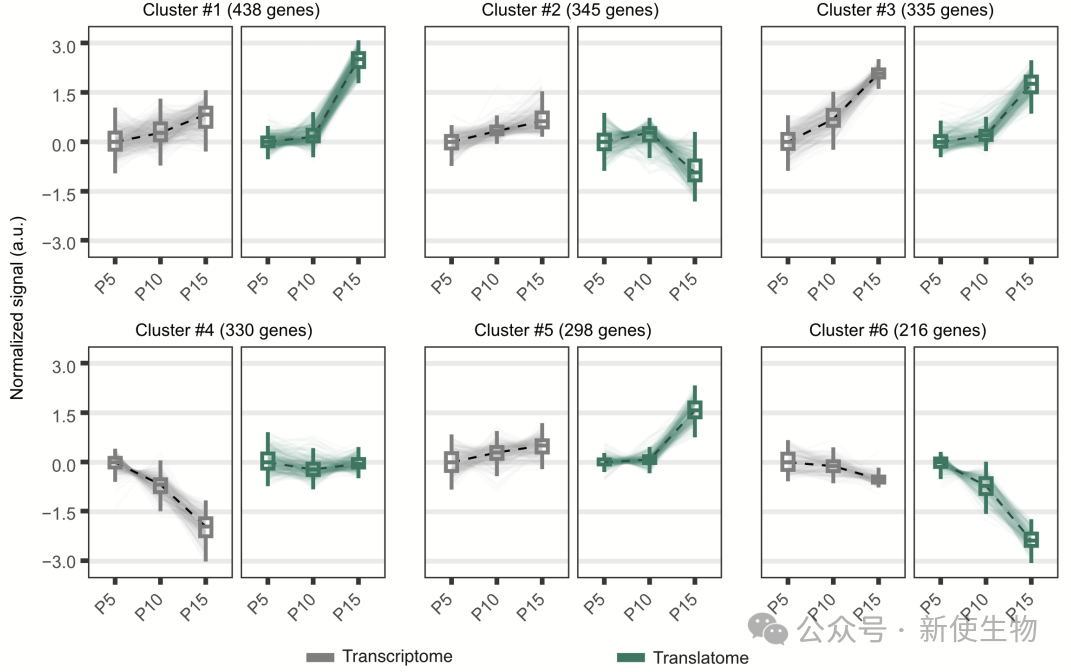
通过积累,作者将差异表达基因(DEGs)分为四类,揭示了运动神经元翻译组在小鼠出生后前两周的动态变化。大多数变化主要出现在翻译水平,且独立于转录水平的变化。
作者对翻译聚类中基因进行了功能富集分析,发现多个聚类与突触消除相关的细胞表面相互作用和轴突/突触功能有关。
随后,利用IPA筛选出10种可系统性投递且安全的小分子药物,并聚焦于其中具有神经相关潜力的6种(如芬戈莫德、氯沙坦等),评估其对突触消除进程的影响。
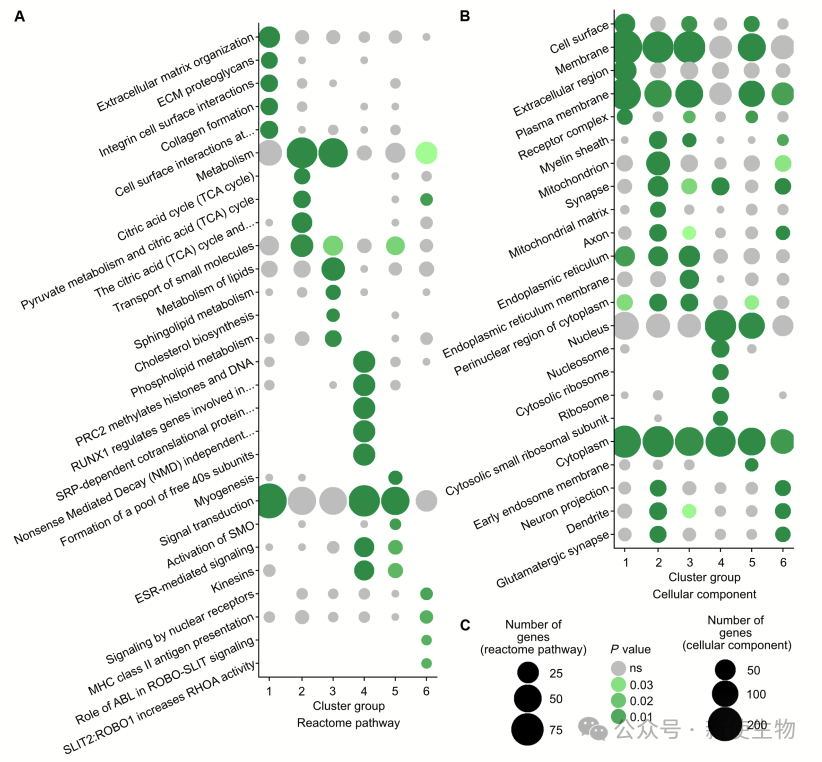
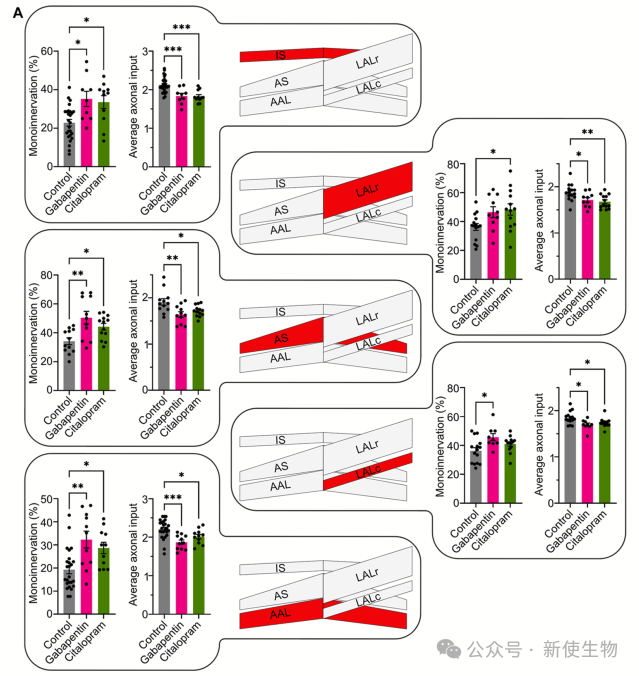
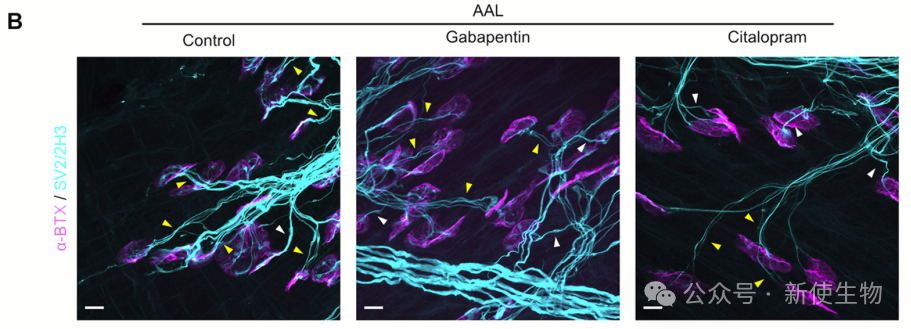
本研究发现在小鼠出生后两周内,运动神经元的翻译组动态变化,主要独立于转录调控,部分翻译基因簇与突触消除相关,药物干预可加速该过程,揭示了突触消除的分子机制和潜在调控靶点。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
