线粒体翻译调控能够精确控制线粒体基因组编码的疏水性蛋白的合成,协调它们的膜插入、积累以及组装成氧化磷酸化(OXPHOS)复合物。
最新研究表明,翻译的各个阶段(起始、延伸、终止和循环再利用)都受到复杂机制的调控。这些机制包括mRNA结构、特化翻译因子以及独特的调控方式,能够调节蛋白质水平以实现化学计量比的组装。
翻译调控的关键发现包括mRNA编程的核糖体停顿、移码翻译以及依赖终止的再起始机制,这些机制精细调控蛋白合成,并促进双顺反子转录本中重叠开放阅读框(ORF)的翻译。
2025年4月11日,美国迈阿密大学Antoni Barrientos团队在Trends in Biochemical Sciences上发表了一篇题为“Emerging mechanisms of human mitochondrial translation regulation”的综述,整理了最近线粒体翻译方面研究进展,加深了对线粒体基因表达的理解。

mRNA翻译是基因表达的最后一步,决定蛋白质的生成。相比细胞核系统,线粒体翻译机制了解较少,但近年来对此研究的进展非常显著。
线粒体翻译系统源于细菌,保留了部分保守机制,同时演化出适应无5′引导序列mRNA和重叠ORF的特化机制,用于合成13种由线粒体基因组编码的氧化磷酸化亚基。
人线粒体mRNA多为多顺反子转录本,经剪切、加尾后成为成熟mRNA,由LRPPRC和SLIRP复合物调控稳定性与翻译。线粒体核糖体具有独特结构,支持疏水性蛋白的共翻译膜插入。
新技术如冷冻电镜、mitoDMS-MaPseq、Ribo-seq翻译组测序等揭示了起始、延伸、终止及循环阶段的精细调控机制,包括mRNA驱动的核糖体停顿、移码翻译和共翻译装配等,为理解线粒体蛋白合成和其在疾病、衰老等过程中的作用提供了新视角。
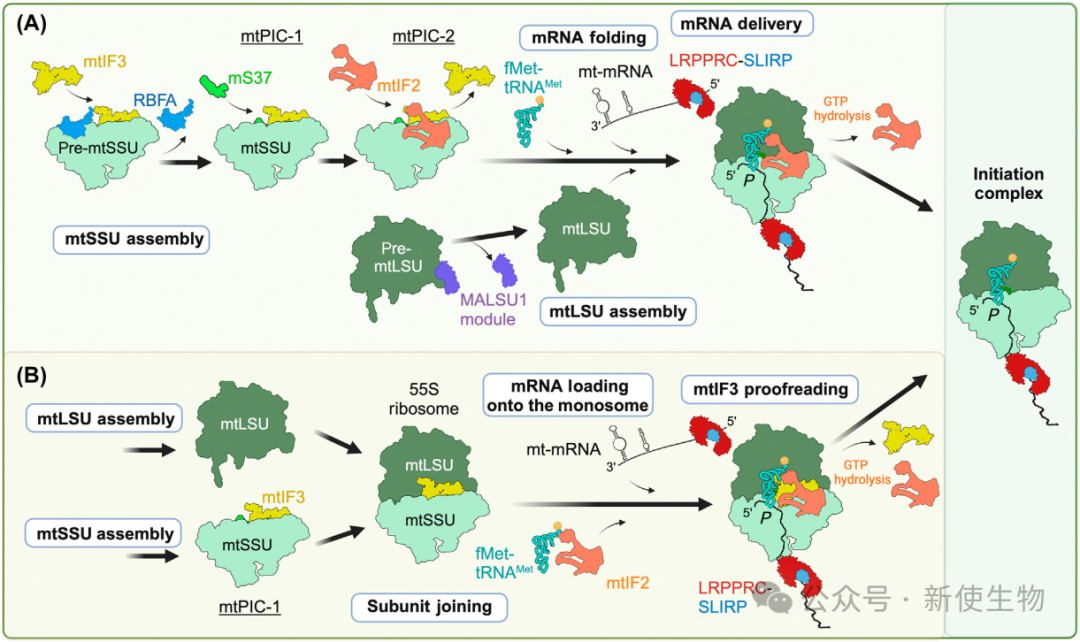
线粒体翻译起始在无引导序列转录本中由mtIF2和mtIF3协调进行,mtIF3防止亚基过早结合,并与mtSSU共同形成前起始复合体mtPIC-1。
在翻译起始过程中,mtIF2引导fMet-tRNAMet的招募,而mtIF3确保正确的密码子配对。mtIF3还在无引导序列mRNA的翻译中起到校对作用,确保即使是非AUG起始密码子也能准确翻译。
LRPPRC-SLIRP模块帮助mRNA与mtSSU结合,并将mRNA递送到翻译起始通道,此机制与细菌中的无引导序列mRNA加载过程相似。
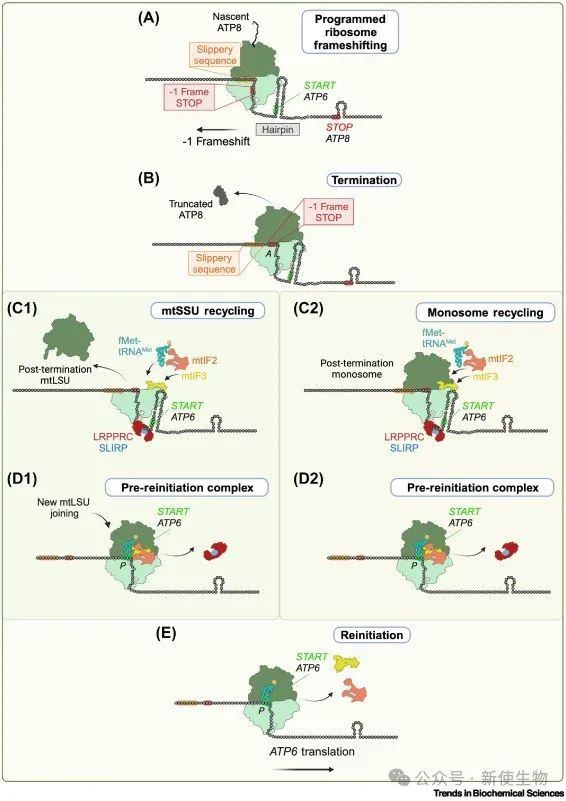
人类线粒体的双顺反子转录本MT-ATP8/6和MT-ND4L/4包含重叠的ORF,后者位于-1框架,给翻译过程带来挑战。
MT-ATP6的翻译依赖于MT-ATP8的翻译,而MT-ND4L/4的翻译机制尚不完全明确。MT-ATP8/6的重叠区域具有发夹结构,可能触发程序性核糖体框移(PRF),导致ATP8的截短多肽(ATP8Tr)生成并被迅速降解。
MT-ATP6和MT-ND4的翻译都依赖于mtIF3,且可能通过终止依赖性再起始(Te-Re)机制进行翻译耦合。LRPPRC/SLIRP复合物可能在MT-ATP6翻译中发挥作用,维持平衡的表达。
瑞他帕林(Retapamulin)是一种胸孢类衍生物,通过结合细菌核糖体的P位点和肽酰转移酶中心,抑制肽酰转移酶活性,阻止启动子tRNA结合。
它有效阻断线粒体翻译起始,并揭示了线粒体转录组中最多31个加密翻译起始位点,可能生成N端缺失的蛋白。此过程可能通过mtIF3回收核糖体,在附近的加密位点启动翻译。
线粒体翻译延伸通过氨酰-tRNA结合、肽键形成、核糖体转位和tRNA释放等周期进行。
mtEF-Tu与GTP和氨酰-tRNA形成复合物,送tRNA至核糖体A位点,mtEF-Ts促进GTP的交换,mtEF-G1催化转位。mL40、mL48和mL64蛋白通过构象变化支持tRNA从A位点转位到P位点再到E位点。mL45蛋白在出口通道与核糖体接触,并帮助新合成多肽的出口。
翻译延伸速率受密码子使用、tRNA丰度等因素调控,特别是对跨膜蛋白和大分子复合物的合成至关重要。
mRNA二级结构在细胞线粒体翻译延伸中起着重要的调控作用,特别是在mRNA程序化翻译暂停中。这种暂停有助于具有多个跨膜结构域的蛋白质正确折叠和膜整合。
线粒体mRNA中,发夹结构常出现在跨膜编码区域,促进翻译暂停,帮助新生蛋白正确折叠和组装。例如,MT-CO1 mRNA中的发夹结构促进翻译暂停,并与伴侣蛋白COX14和COA3共同作用,稳定并促进蛋白质的组装。
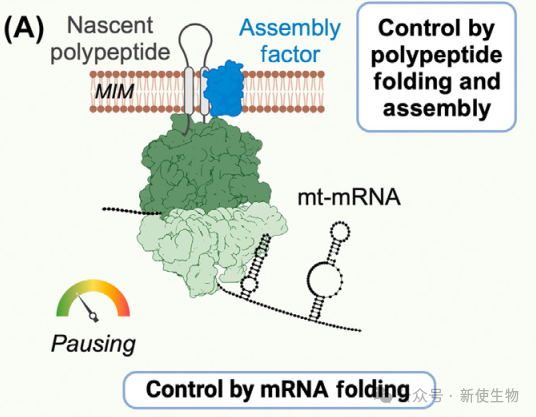
线粒体翻译延伸中的一个未被充分探讨的方面是共翻译组装对延伸速率的调节作用。由于线粒体DNA编码的蛋白质是OXPHOS复合物的重要组成部分,共翻译的组装因子或合作亚基可能通过延伸暂停促进高效组装。
例如,MT-CO1的翻译与细胞色素c氧化酶亚基的共翻译进口相关,组装因子在延伸暂停期间与新生多肽结合,支持其正确折叠和膜插入。这一机制可能有助于适应核编码亚基的组装需求。
进一步研究可能揭示更多的线粒体翻译调控层面,尤其是在能量需求波动时。
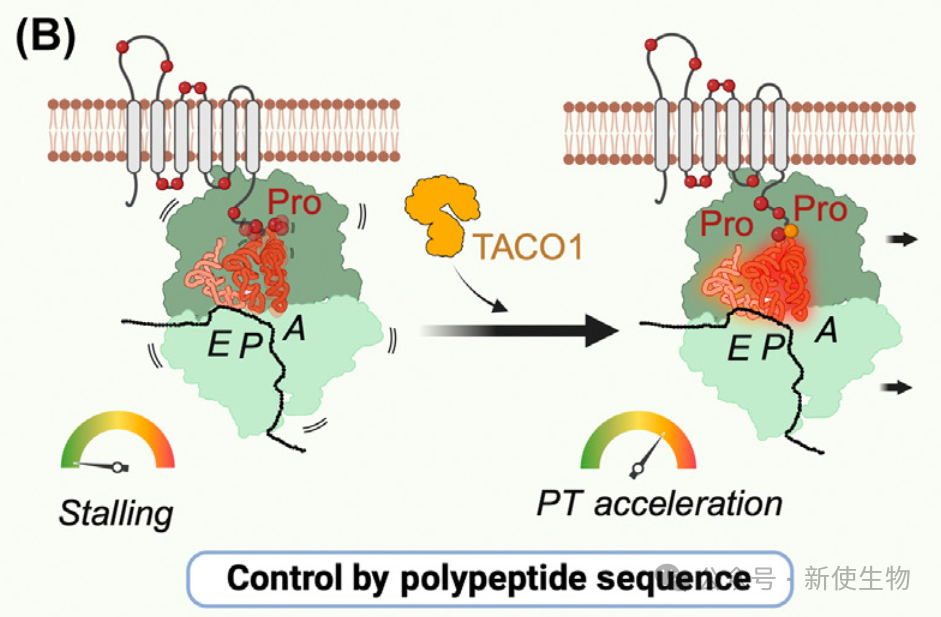
TACO1通过解决线粒体翻译中的核糖体停滞,特别是在脯氨酸富集的PPX基序和其他序列中发挥重要作用。
TACO1的功能类似于EF-P和eIF5A,能够缓解停滞并促进翻译延伸,确保多跨膜蛋白的正确折叠和膜插入。它通过独特的机制调节翻译延伸,有助于解决由脯氨酸等基序引起的停顿,增强线粒体翻译的效率。
4.1)翻译终止的专门因子调控
线粒体翻译终止依赖于一系列专门因子,如mtRF1a和mtRF1,它们通过识别标准和非典型的停用密码子来促进蛋白质合成终止。
mtRF1a主要识别UAA和UAG停用密码子,而mtRF1识别AGA和AGG。mtRF1a通过与小亚基解码位点和大亚基PTC相互作用来催化新生多肽的释放。MT-ND6的终止机制较为复杂,可能涉及平行机制或不同释放因子的补偿作用。
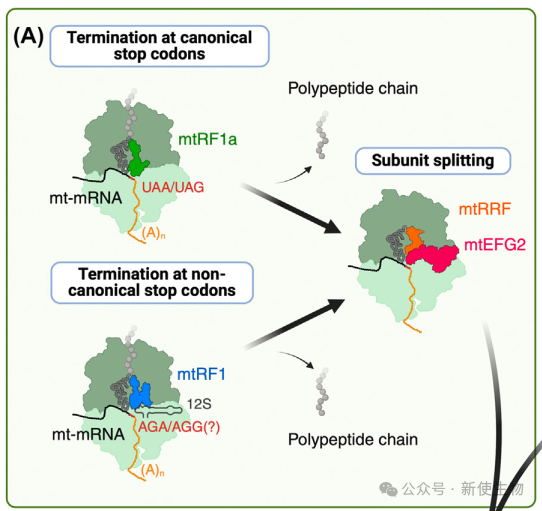
翻译终止对蛋白质质量控制至关重要,尤其是在翻译停滞或RNA受损时。线粒体缺乏细菌的翻译系统,但保留了两个I类释放因子(mtRFR和ICT1)。
mtRFR在解决由于异常tRNA多腺苷酸化引起的停滞中发挥作用,释放停滞的多肽链。ICT1则作为结构组件,帮助在遇到截短mRNA时切除多肽链。两者都参与线粒体核糖体的质量控制。
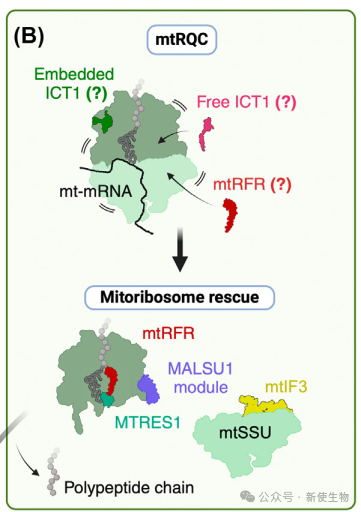
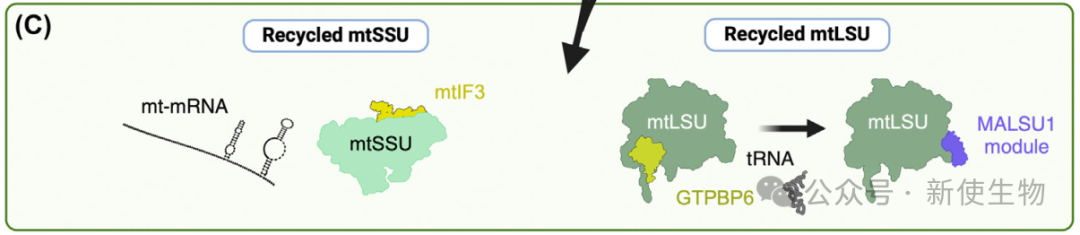
线粒体核糖体回收由mtEF-G2和mtRRF介导,mtEF-G2在翻译终止后与mtRRF结合,解离核糖体子单位,为下一轮翻译做好准备。另外,GTPBP6也作为替代回收因子参与此过程。
人类线粒体翻译对细胞能量生产和生物体稳态至关重要,依赖于核编码蛋白和线粒体编码RNA的协同作用。
这些研究揭示了线粒体翻译的机制,包括线粒体核糖体的演化适应、特化的翻译机器和mRNA折叠对翻译效率的影响。然而,线粒体翻译如何应对环境压力和与细胞信号通路整合的机制仍不明确。
未来研究应采用先进技术如冷冻电子显微镜、高通量测序等,以揭示新的调控机制,并探讨线粒体翻译失调在多种疾病中的作用。
新使生物NeoRibo推出国内首个低起始量超高分辨率翻译组Ribo-seq服务。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
