由于翻译需大量能量,翻译起始成为基因表达快速调控的限速步骤。在真核生物中,十余种起始因子(eIFs)与小亚基、Met-tRNAiMet协同作用,从5′至3′扫描mRNA 5′ UTR,精准识别起始密码子。
起始复合物的组装依次经历43S起始前复合物、eIF4F复合物(含eIF4E、eIF4G、eIF4A)介导的帽结构识别、再至48S复合物的形成与大亚基结合,最终完成80S复合物的构建。扫描过程中,eIF4A及其辅助因子解开mRNA结构,直至Met-tRNAiMet与起始密码子配对完成识别。
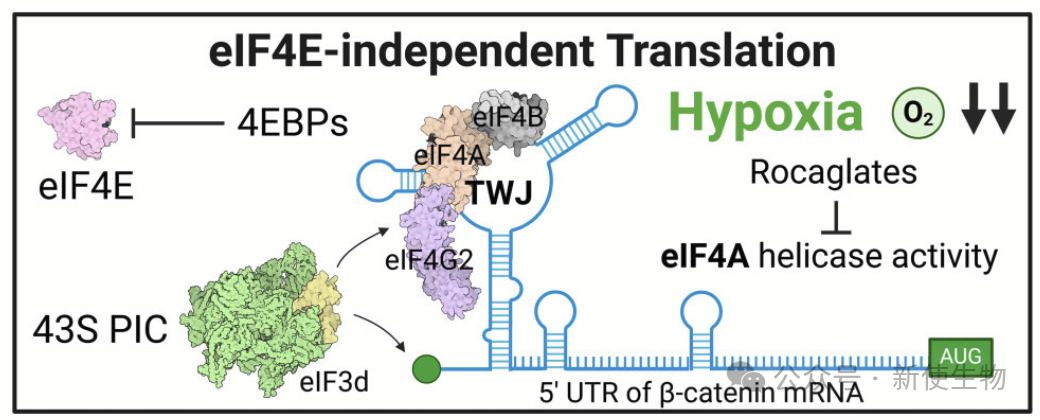
在低氧等应激条件下,经典翻译机制受阻,癌细胞依赖5′UTR中的顺式元件及相关因子激活替代起始通路,保障如β-catenin、MYC等关键蛋白的合成,维持其翻译有助于癌细胞的适应与存活。
人类CTNNB1编码β-连环蛋白,是果蝇Armadillo的同源物,在细胞黏附与Wnt信号中分别发挥结构与转录调控功能。其蛋白水平在化疗诱导的低氧中升高,而mRNA未见显著变化,提示其5′ UTR中可能存在IRES等顺式元件介导的替代翻译机制,但目前尚未完全明确。
2025年5月1日,法国斯特拉斯堡大学生物学研究所Angelita Simonetti团队在Nucleic Acids Research上发表了一篇题为“A structural element within the 5′UTR of β-catenin mRNA modulates its translation under hypoxia”的论文,发现β-连环蛋白mRNA 5′ UTR中一个富GC的三分叉结构可增强其低氧下的eIF4A依赖性翻译,并对Silvestrol敏感,揭示了其在癌症中可被靶向的翻译调控机制。

索引
【IF】16.97
研究结果
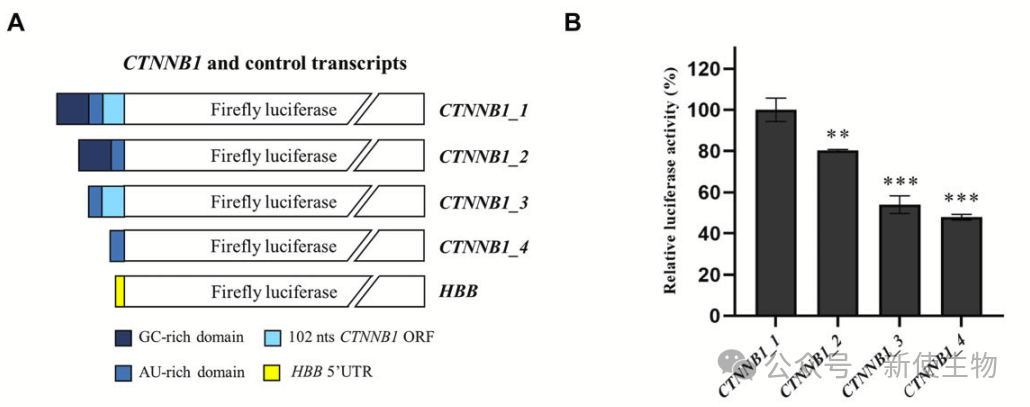
作者通过化学探针法解析了人β-连环蛋白mRNA的5′ UTR结构,发现其包含两个区域:一个富GC的三分叉结构(TWJ),含嘌呤富集区,结构紧密以及一个AU-rich的松散区域,其中AUG位于强Kozak序列中的单链区。
除此之外,他们还构建了缺失GC-rich区的截短突变体,用于评估其对翻译的影响。

研究表明β-连环蛋白5′UTR中的GC-rich区域和TWJ结构对其翻译效率非常重要,缺失该区域会显著降低翻译水平,且该区域在低氧条件下对β-连环蛋白的翻译具有重要作用。
三. GC-rich元素在低氧条件下促进β-连环蛋白翻译增强
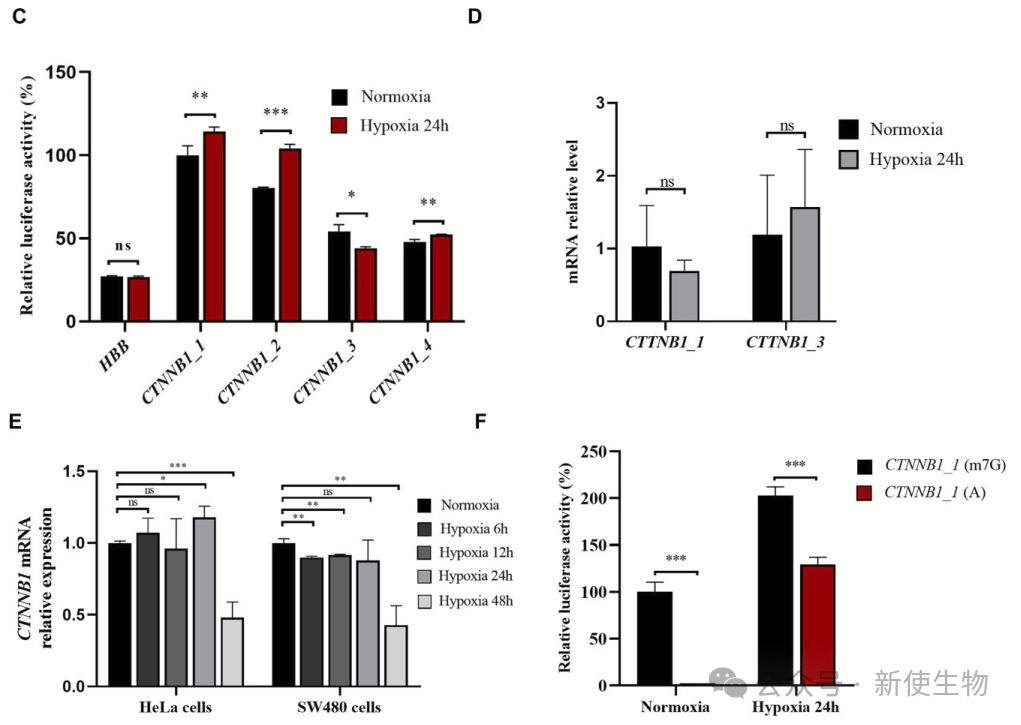
低氧条件下,全局翻译受抑制,但某些与应激适应和细胞生理维持相关的mRNA翻译仍然进行。
通过在HeLa细胞中转染带有β-连环蛋白5′ UTR的报告基因,作者发现GC-rich元素及其三分叉结构(TWJ)在低氧条件下促进β-连环蛋白的翻译。
此外,尽管低氧抑制了常规eIF4E依赖的翻译途径,β-连环蛋白的翻译依赖于其5′ UTR的GC-rich元素和TWJ结构,绕过了eIF4E依赖的5′帽识别机制。
四. 质谱分析揭示低氧条件下特定eIFs在结合β-连环蛋白mRNA的HeLa 48S翻译起始复合物中的含量增加
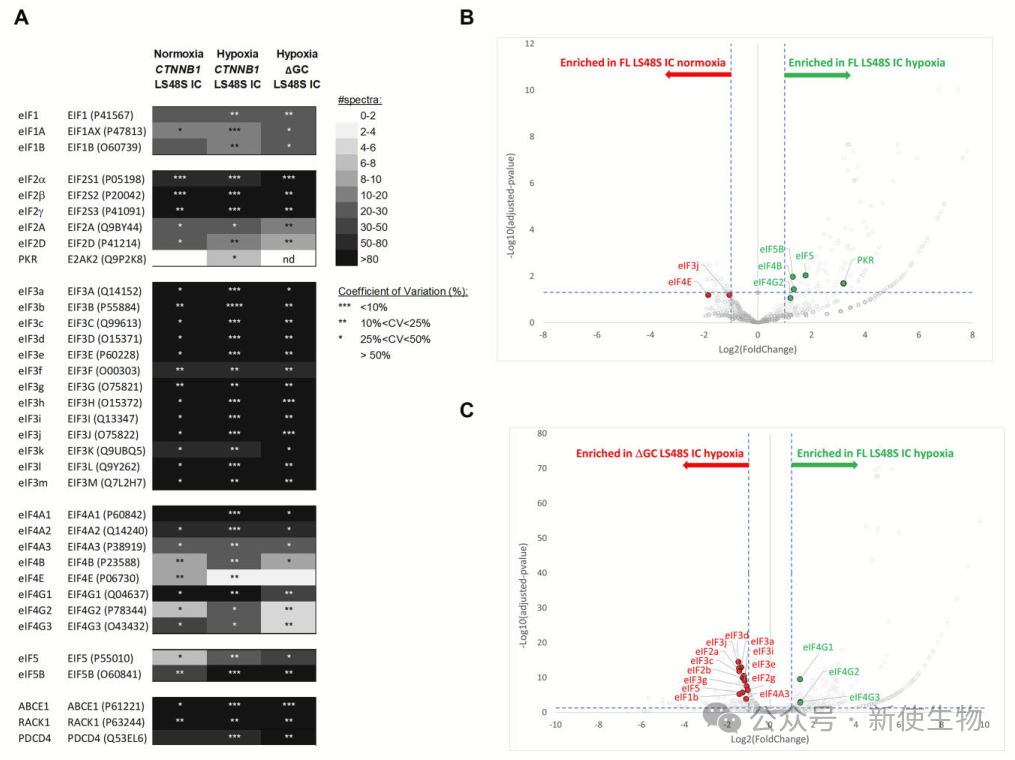
质谱分析揭示,在低氧条件下,eIF4A和eIF4B与β-连环蛋白5′ UTR的GC-rich元素直接结合,促进了翻译起始复合物(43S PIC)的招募,从而增强翻译效率。
这些发现表明,低氧下β-连环蛋白翻译的调控机制通过eIF4A和eIF4B的相互作用发挥作用,而不依赖于eIF4E。
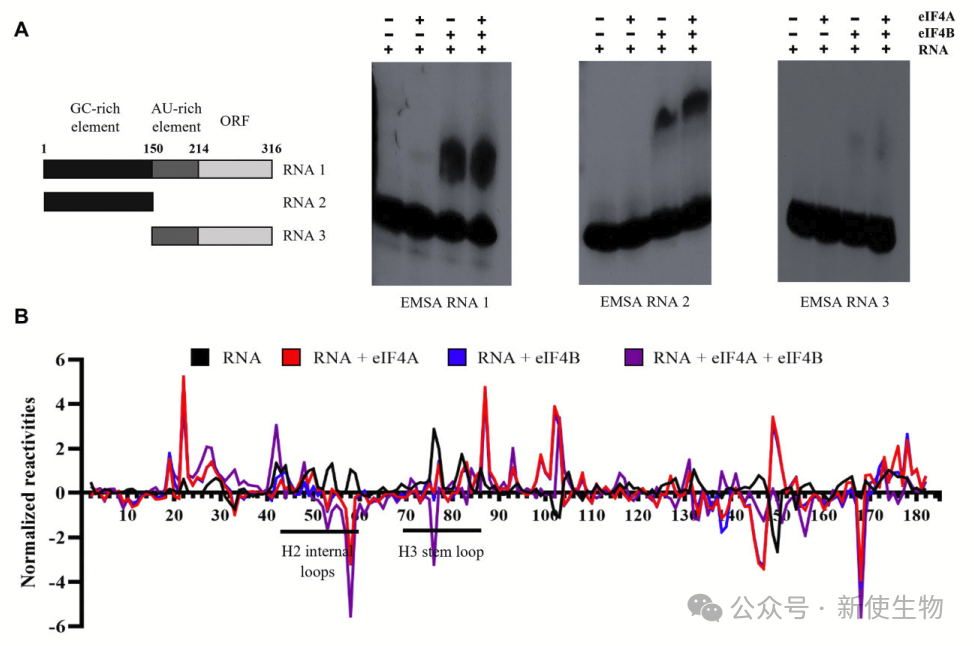
五. GC-rich元素使β-连环蛋白mRNA翻译对silvestrol敏感
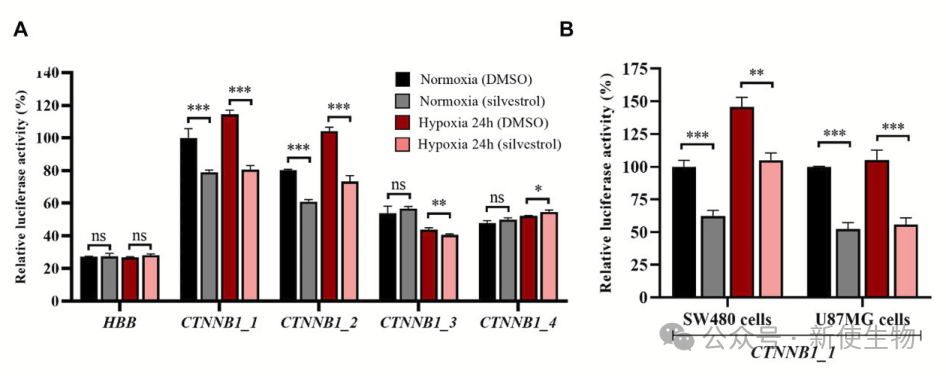
Silvestrol(一种特异性eIF4A靶向翻译抑制剂)通过靶向eIF4A1抑制含有GC-rich元素的β-连环蛋白mRNA翻译。
研究表明silvestrol在常氧和低氧条件下均能显著抑制β-连环蛋白翻译,具有潜在的抗癌治疗应用。
总结
低氧应激条件下,β-连环蛋白mRNA通过其5′UTR中的GC-rich三路连接结构增强翻译。这一结构通过锚定eIF4A、eIF4B和eIF4G2,依赖eIF4A驱动翻译,并对eIF4A抑制剂silvestrol敏感。该研究揭示了低氧环境下β-连环蛋白翻译的调控机制,为癌症治疗提供了潜在的干预靶点。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
