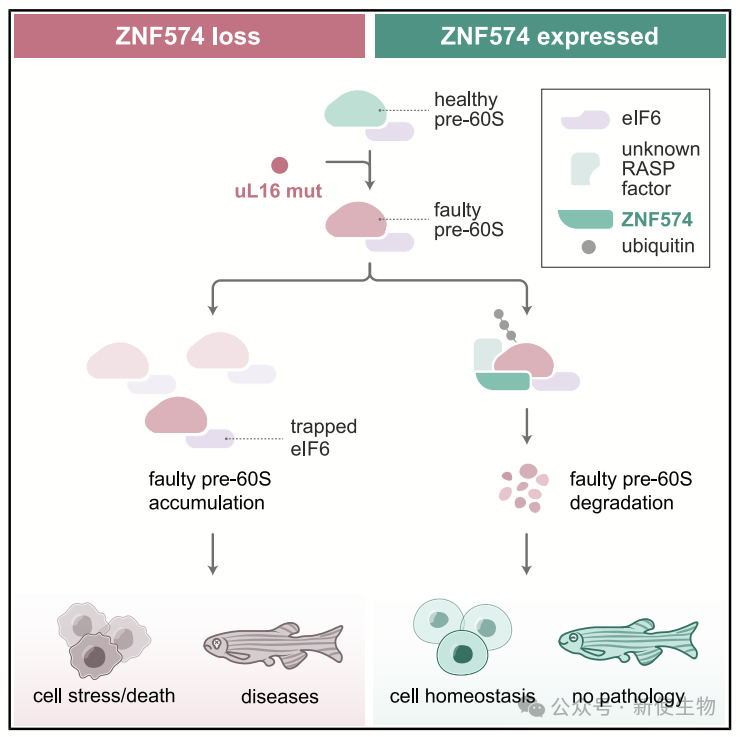
真核核糖体由RNA和蛋白质组成,负责将mRNA翻译为蛋白质。其复杂组装过程需约200种蛋白因子和多种小RNA在核仁、核质与细胞质中协调进行,易受环境胁迫、基因突变、转录翻译错误及修饰缺陷干扰,导致功能异常的中间体积累,进而影响蛋白合成、诱发细胞应激甚至死亡。在有机体层面,这些缺陷可引发多种组织病变。
虽然已有研究聚焦于核糖体正确组装,但对异常前体核糖体的质量控制机制了解甚少。因为目前缺乏有效识别与分离缺陷核糖体的方法,限制了研究进展。已有研究者尝试通过诱导应激或操控组装因子来积累错误核糖体,但往往严重损害细胞活力,干扰结果解读。

文章索引
【发表日期】2025年5月5日
【IF】15.58
研究结果
作者在K562细胞中构建了表达突变核糖体蛋白uL16(uL16mut)的系统,模拟核糖体大亚基组装缺陷,并用Polysome profiling多聚核糖体分析进行了验证。
uL16mut缺失关键残基,阻碍肽酰转移酶中心形成,导致其组装进60S但无法进入翻译。通过表位标签追踪,他们发现这些缺陷60S富集了晚期组装因子(如eIF6),阻止其与40S结合,证实uL16mut阻断了60S成熟。
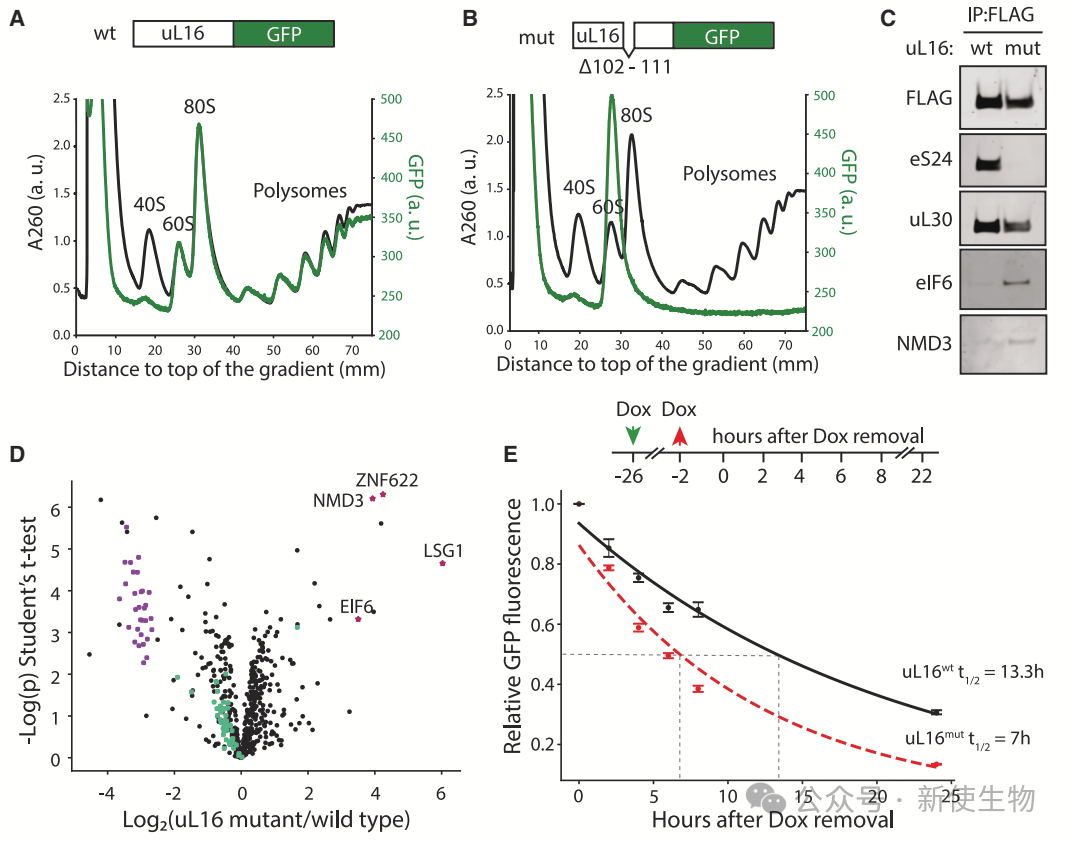
作者在K562细胞中检测到uL16mut的半衰期为7小时,表明其被主动清除。自噬抑制未能稳定uL16mut,而蛋白酶体抑制剂bortezomib则可稳定uL16mut,并检测到其泛素化,证明60Smut通过泛素-蛋白酶体系统降解。
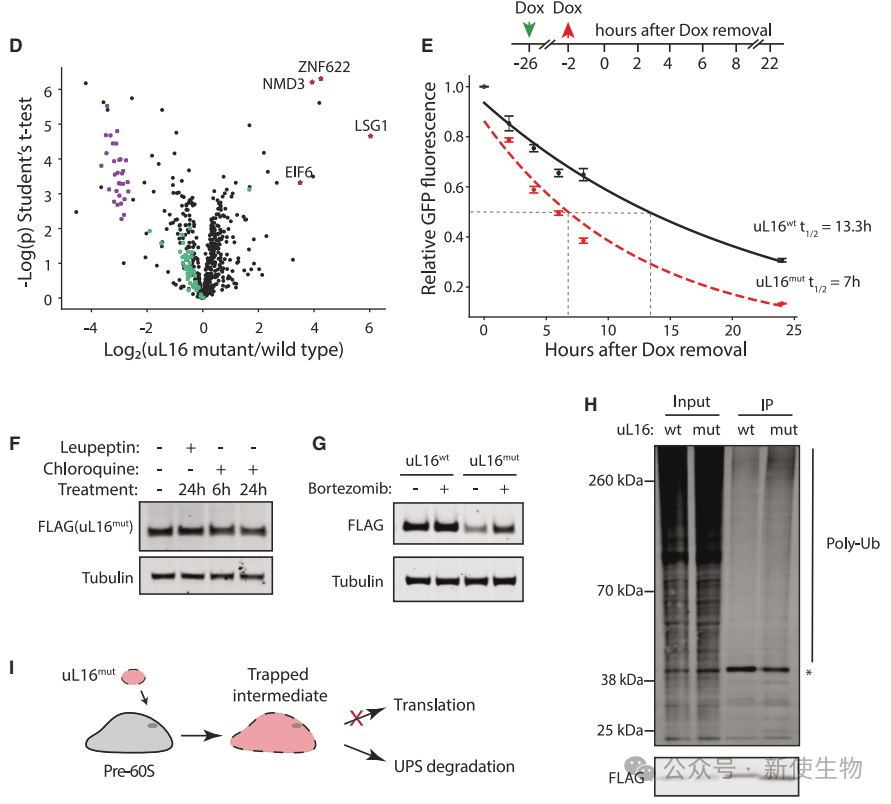
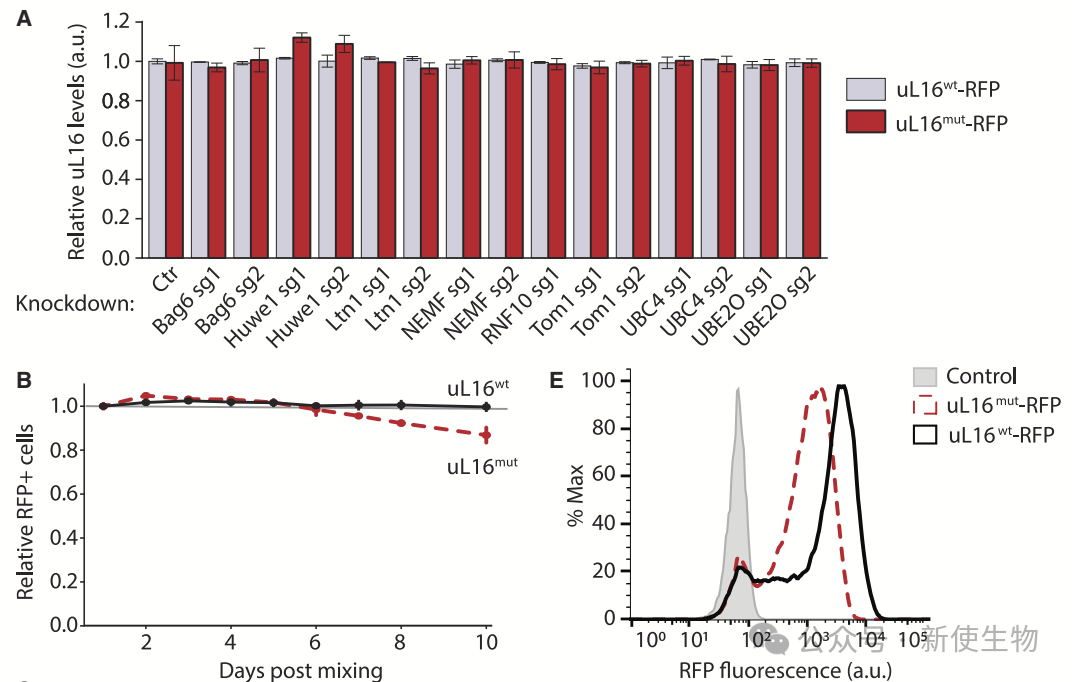
通过CRISPRi筛选,研究团队发现ZNF574是RASP途径中的关键因子。ZNF574缺失会抑制uL16mut细胞增殖并稳定uL16mut-RFP蛋白,确认其在uL16mut降解中发挥特异性作用。
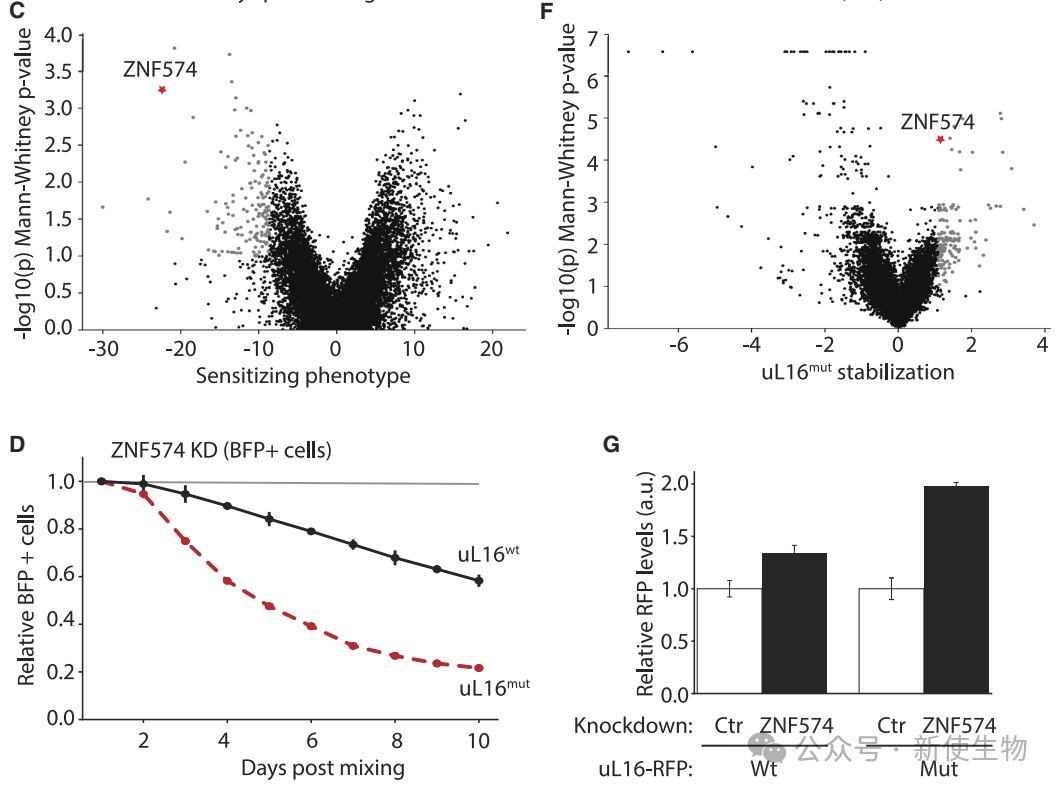
团队通过Polysome profiling多聚核糖体分析和免疫共沉淀分析,确认ZNF574与60Smut亚基发生细胞质中的相互作用。
ZNF574通过靶向整个60Smut亚基,促进其降解,而不是释放游离的uL16mut,进一步证明ZNF574在核糖体质量控制中的作用。
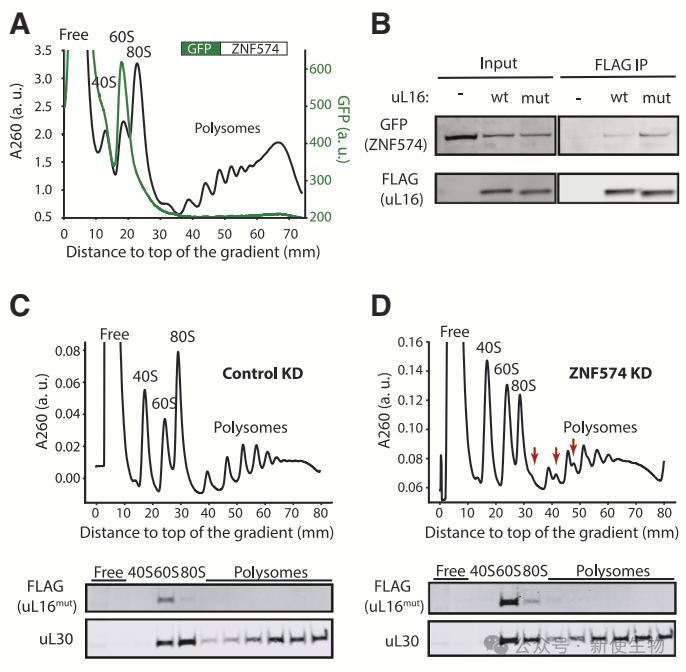
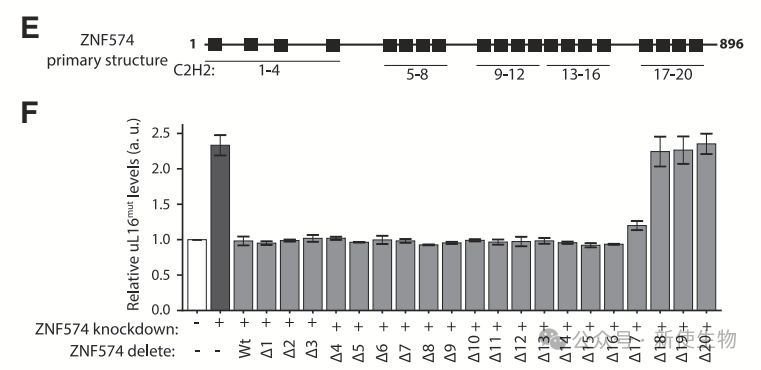
ZNF574的最后四个C2H2结构域对uL16mut降解至关重要。删除这部分结构域会干扰ZNF574介导的质量控制,且该区域足以单独执行uL16mut的降解。
ZNF574敲低会延长uL16mut的半衰期,确认其在uL16mut降解中的关键作用。
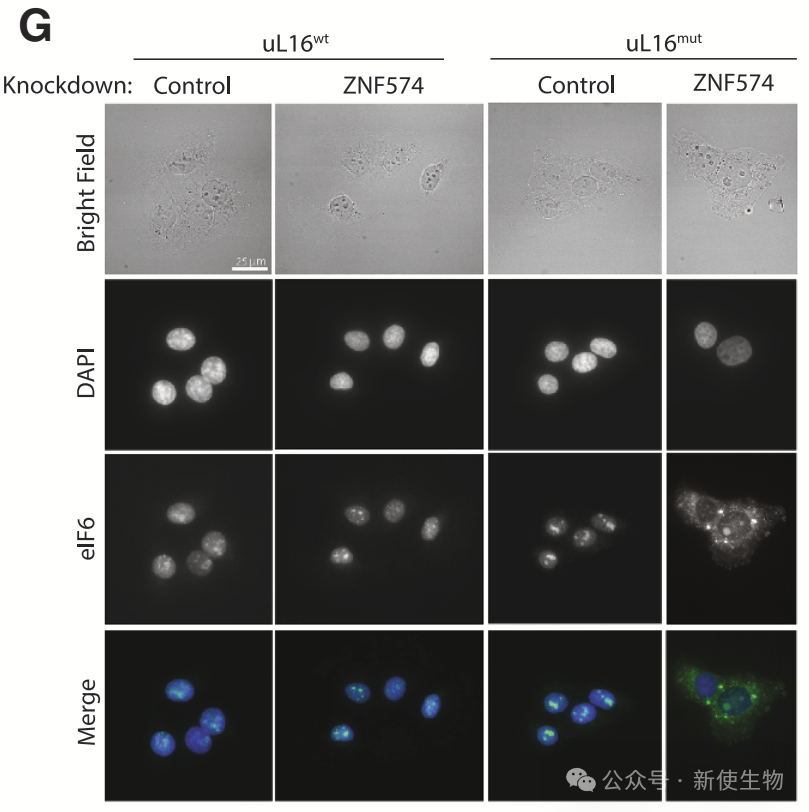
ZNF574缺失在uL16mut表达细胞中导致60S亚基生产或连接缺陷,表现为异常的多聚核糖体。ZNF574去除使得生物合成因子(如eIF6)被困在细胞质中,影响核糖体组装,提示RASP通路在核糖体组装中的重要作用。
ZNF574通过冷冻电镜分析发现,60Smut的PTC采用成熟构象,但仍保留eIF6,阻碍其释放,表明ZNF574可能作为成熟定时器。
ZNF574结合并降解停滞的核糖体生物合成中间体,如减缓生物合成的uL16突变体(R98S),而不影响成熟60S亚基的功能。
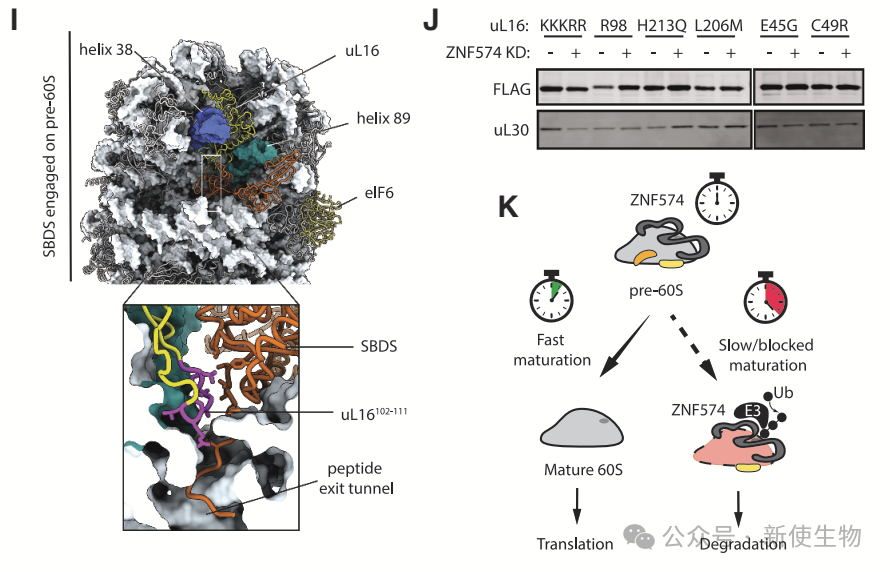
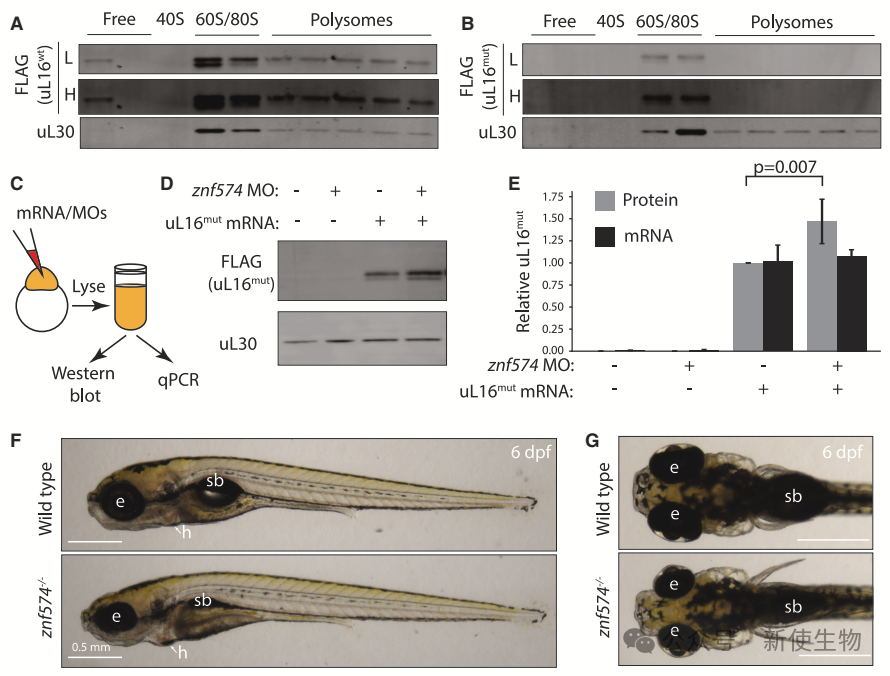
ZNF574在低等脊椎动物斑马鱼中也具有保守性,缺失ZNF574导致uL16mut蛋白积累,证明其在RASP中必需。
斑马鱼突变株znf574−/−表现出致死性和形态学缺陷,类似于斑马鱼核糖体病模型,这些表型与核糖体合成中间体积累相关。
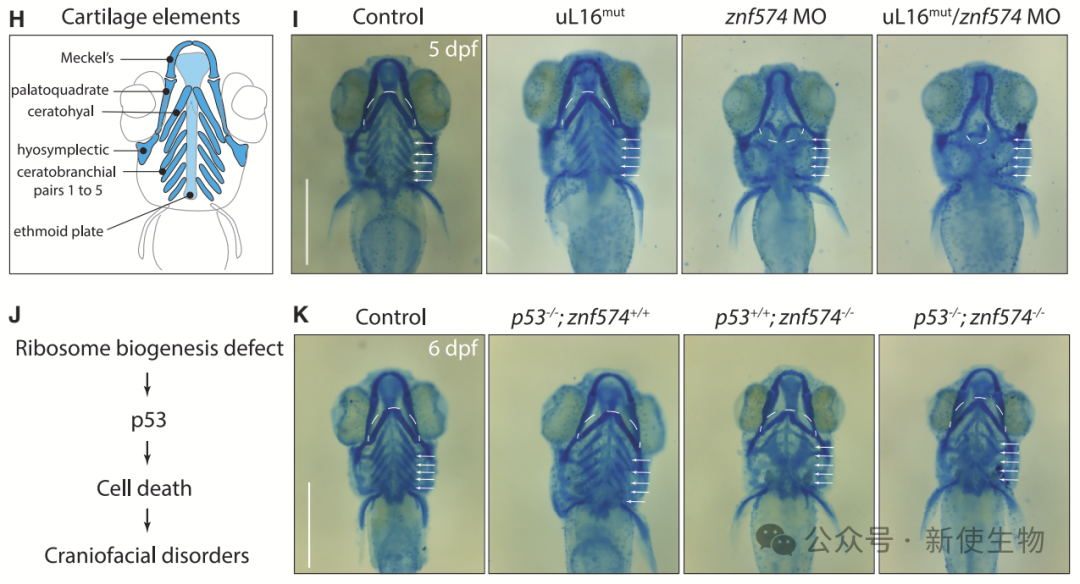
RASP缺失导致颅面软骨发育不良,且与核糖体生物合成缺陷协同作用。Tp53通路激活引发细胞凋亡,通过交配Tp53缺失斑马鱼,改善了软骨发育,证明RASP缺失通过Tp53介导的细胞死亡影响发育。
本文在人体细胞中设计了一种扰乱核糖体组装的系统,发现有缺陷的核糖体通过泛素-蛋白酶体系统被降解。研究鉴定出ZNF574作为核糖体组装监控通路(RASP)的关键组成部分。在动物模型中,ZNF574的缺失导致发育缺陷,强调了RASP在生物体健康中的重要性。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
