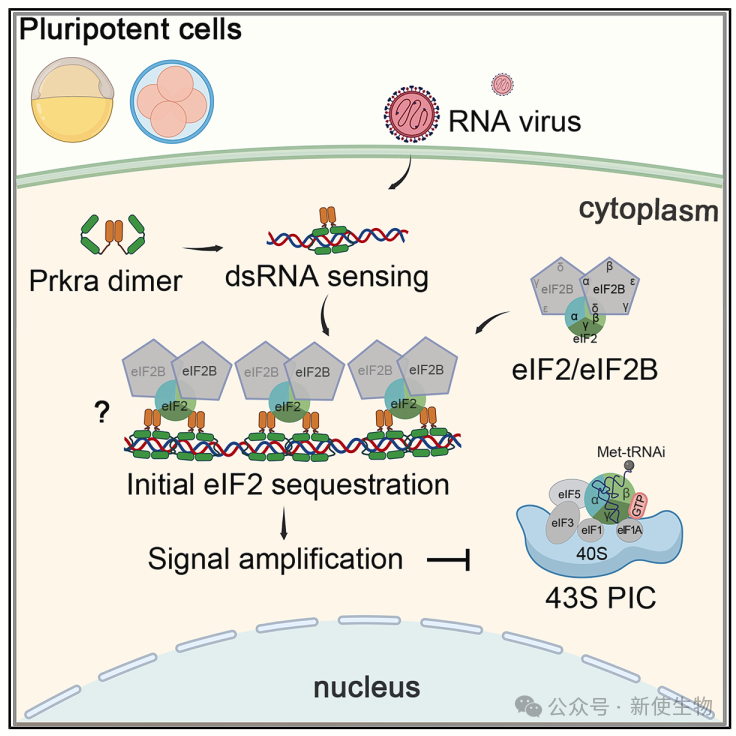
在本期Molecular Cell杂志中,邵明团队报道了Prkra(在人类中称为PACT)在应对双链RNA刺激时介导的保守性全局翻译抑制作用,发现Prkra可直接结合RNA,并以一种不依赖PKR的方式将eIF2复合物隔离。

在本期Molecular Cell中,研究者发现Prkra(PACT)可通过结合双链RNA(dsRNA)并隔离eIF2复合物,在不依赖PKR的情况下介导保守性的翻译抑制。
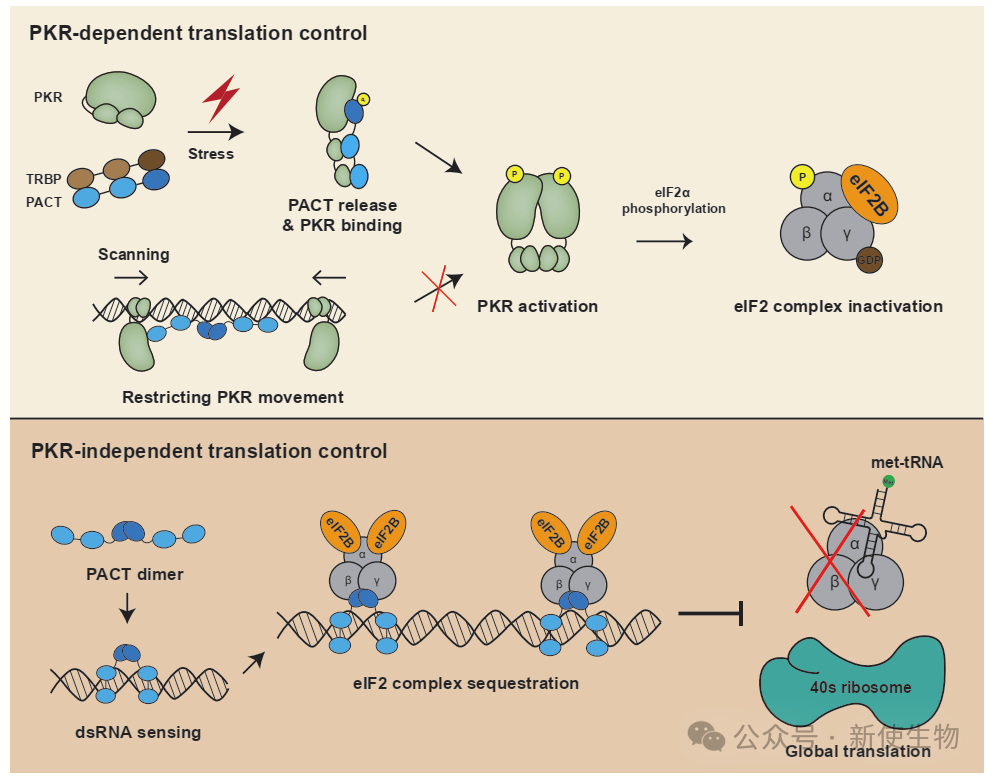
dsRNA是病毒感染的标志,通常激活PKR,进而通过磷酸化eIF2α抑制翻译并诱导干扰素表达。尽管PKR也可在无感染状态下因应激被激活,但其活性受包括Prkra在内的多个因子的调控。以往研究主要聚焦Prkra如何通过PKR间接调控翻译,但机制不清。邵明团队首次证实Prkra可独立于PKR,直接响应dsRNA并调控全局翻译。
早期胚胎及多能细胞具备特殊免疫调控机制,因其dsRNA传感器表达低,PKR 功能有限。研究发现,斑马鱼胚胎中PKR表达低,干扰素反应受限,而ISGs的基础表达提供免疫保护。在这一环境中,Prkra发挥核心dsRNA感应功能。
该文章揭示,Prkra二聚体可与dsRNA结合并形成有序结构,从翻译系统中隔离eIF2复合物,实现eIF2α非磷酸化依赖的翻译抑制。Prkra缺失会破坏该结构并削弱抗病毒功能,该机制在胚胎干细胞中同样保守。
在人细胞系中,PRKRA曾被认为参与miRNA加工及PKR活性调控,但多项实验证明其作用依赖于特定背景。该研究证实,Prkra可直接结合dsRNA并调控翻译,而非通过PKR。该机制在分化细胞中同样有效,提示其广泛的适用性。
此外,胚胎和多能细胞进化出独特的抗病毒方式,在关键发育阶段通过Prkra抑制翻译而非激活炎症,以应对来自内源dsRNA的潜在威胁,保障细胞稳态。
尽管ISR路径仍重要,Prkra提供了另一种翻译调控途径。未来研究需进一步揭示Prkra的分子特性、激活条件及其调控是否受内源dsRNA水平变化的影响。
综上,这项研究拓展了大家对翻译调控与免疫策略的认识,特别是在干细胞等免疫豁免环境中的应用潜力。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们