
导读
光系统II (PSII) 的光抑制(photoinhibition)现象限制了光合作用固定光能的效率,进而影响全球植物的生产力。光合生物进化出了一套精密的保护机制,通过增强对受损PSII的修复来对抗光抑制。
然而,当植物遭遇氧化胁迫或其他环境胁迫时,会产生大量活性氧(ROS),这些活性氧会抑制蛋白质的合成,从而阻碍修复进程。长期以来,ROS抑制蛋白质合成的分子机制尚不明确。
2025年8月21日,日本埼玉大学Yoshitaka Nishiyama团队在Trends in Plant Science上发表了题为“Elongation factors regulate the repair of photosystem II oxido-reductively”的综述文章。该文聚焦于翻译延伸因子EF-G和EF-Tu如何通过其保守的半胱氨酸残基的氧化还原状态,来调控PSII的修复过程,从而揭示了环境胁迫、蛋白质合成与光合作用效率之间的分子联系。

综述整理
一、PSII光抑制与氧化应激:修复是调控的关键
光合作用需要光,但过强的光照会通过光抑制现象损伤PSII。
光抑制的程度取决于两个相互竞争过程的动态平衡:光损伤与PSII修复。
当修复速率赶不上损伤速率时,光抑制效应就会显现,而PSII的修复过程极易受到各类环境胁迫的限制。
PSII的修复是一个多步骤的循环过程,其核心是被称为D1蛋白的反应中心蛋白的更新换代。该蛋白对光极为敏感,在强光下容易受损,这些修复循环包括:
1. 受损D1蛋白的降解与移除
2. 从psbA mRNA翻译合成新的D1蛋白前体(pre-D1)
3. 将pre-D1插入PSII复合物
4. 对pre-D1进行加工,生成成熟的D1蛋白
5. 重新组装PSII复合物中的放氧复合物
研究表明,环境胁迫产生的ROS主要通过抑制蛋白质的从头合成 (de novo synthesis) 来阻碍PSII的修复,特别是抑制了翻译延伸这一关键步骤,从而导致pre-D1蛋白合成受阻。
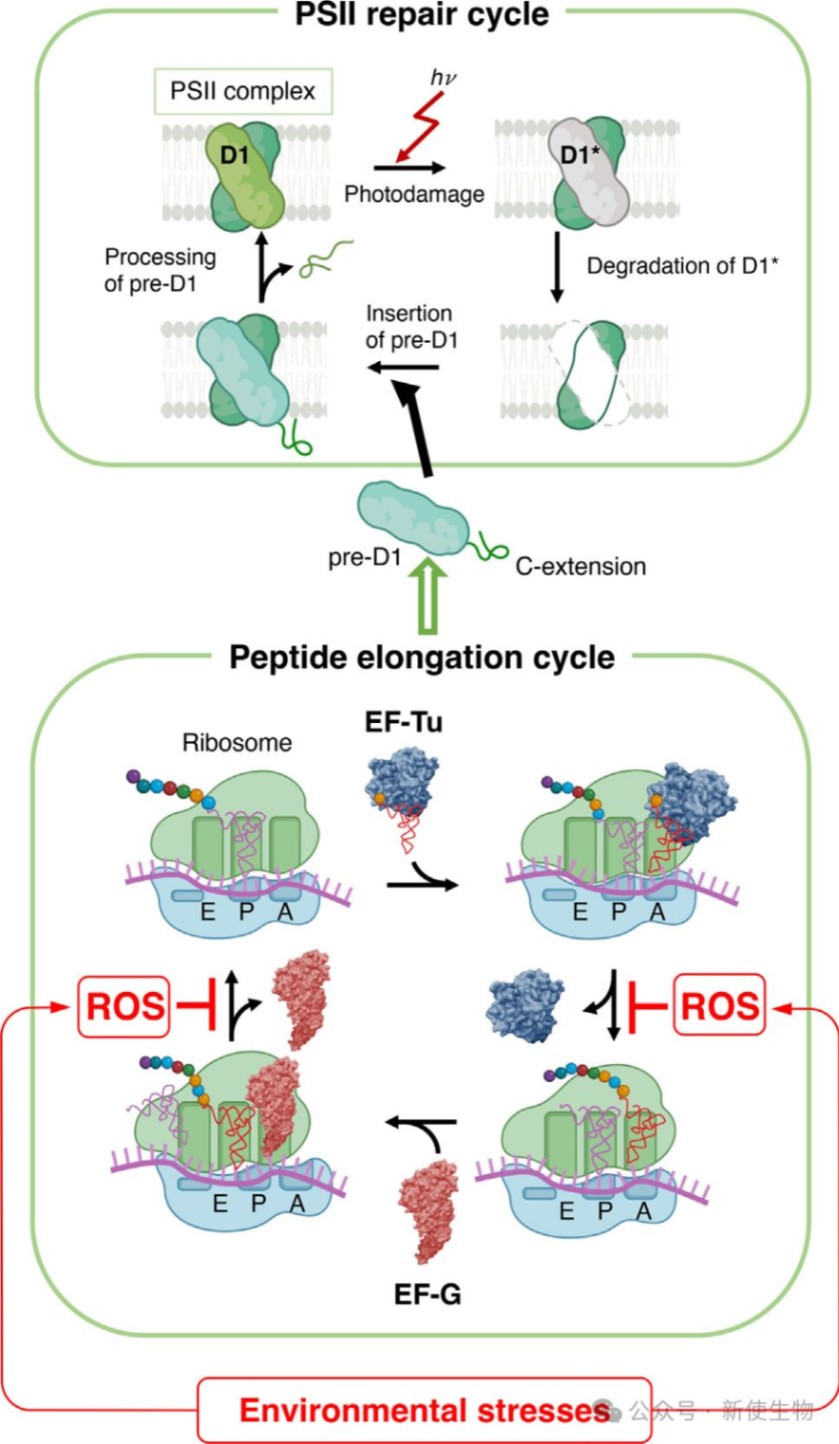
二、翻译延伸因子EF-G和EF-Tu是ROS的关键靶点
蛋白质合成的延伸阶段需要EF-G和EF-Tu两个关键的延伸因子参与,它们都含有对氧化胁迫高度敏感且在原核和真核生物中广泛保守的半胱氨酸残基。
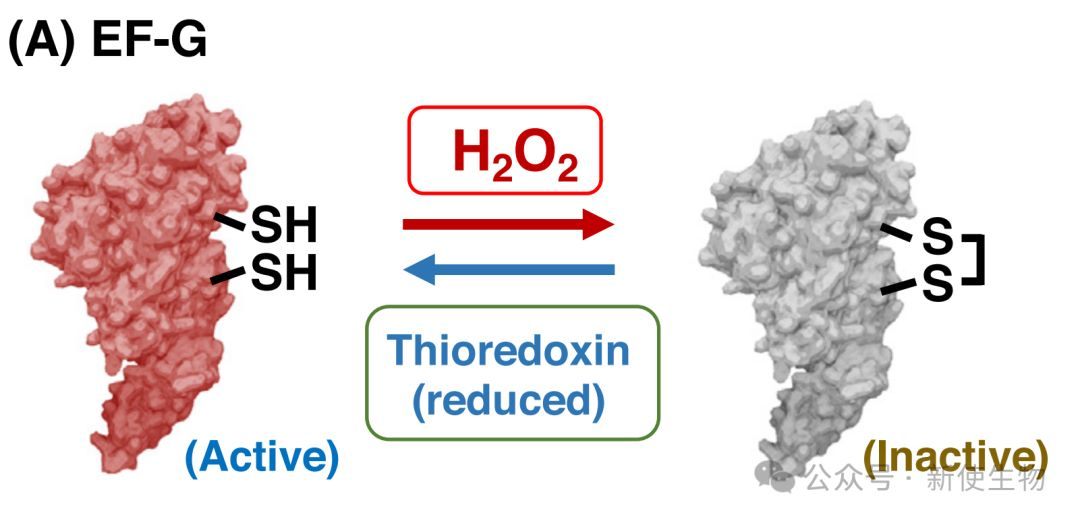
2.1) EF-G:活性氧的关键靶点
在蓝藻(Synechocystis)的体外翻译系统中,研究人员证实H₂O₂能够氧化EF-G,从而抑制psbA2 mRNA的翻译。
当用还原剂处理后,EF-G的活性得以恢复,翻译能力也随之复原,这表明EF-G是翻译机器中被ROS灭活的首要靶点之一。
1.氧化位点:蓝藻中的EF-G(以Slr1463为例)含有五个半胱氨酸残基。通过定点突变研究发现,Cys105和Cys242是主要的氧化位点。在ROS作用下,这两个残基之间会形成一个分子内二硫键。
2.失活机制:EF-G在发挥功能时需要经历剧烈的构象变化。这个新形成的二硫键限制了EF-G的构象灵活性,使其无法有效水解GTP并从核糖体上解离,从而中断了翻译延伸。
3.还原与再激活:失活的EF-G可以被还原型的硫氧还蛋白 (Thioredoxin) 重新激活。硫氧还蛋白从光合电子传递链中获得电子,将EF-G的二硫键还原,使其恢复功能。
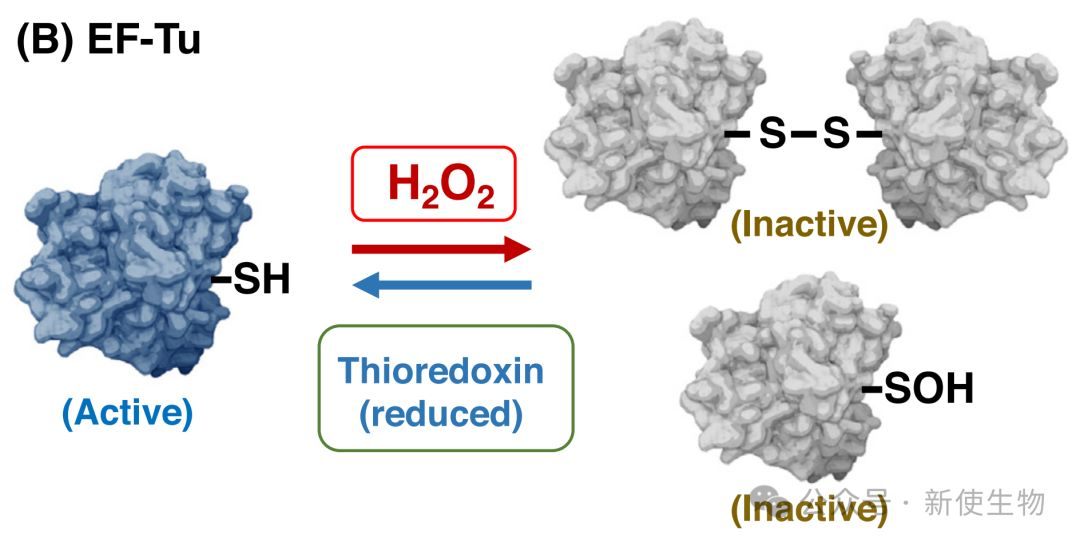
2.2) EF-Tu:ROS的另一个关键靶点
EF-Tu是细胞内最丰富的蛋白质之一,同样也是ROS的关键靶点。与拥有多个基因拷贝的EF-G不同,蓝藻中的EF-Tu仅由一个tufA基因编码。
1.氧化位点:EF-Tu仅含有一个半胱氨酸残基(蓝藻中为Cys82),该位点在原核及真核生物中都惊人地保守。
2.失活机制:Cys82被氧化后,会形成两个EF-Tu分子之间的分子间二硫键以及亚磺酸。这两种氧化修饰都会使EF-Tu失活。
3.还原与再激活:与EF-G类似,氧化的EF-Tu也能被硫氧还蛋白还原并重新激活,表明其活性同样受到精确的氧化还原调控。
在蓝藻中表达抗氧化的突变EF-Tu后,PSII的修复能力得到增强,光抑制现象得到缓解,这一机制可能是一种保护性手段。
在强光下,EF-Tu对氧化的超敏性可以迅速抑制蛋白质合成,避免在无法有效修复PSII的情况下继续产生更多ROS,从而防止氧化损伤进一步扩大。
三、延伸因子水平的调控
在强光胁迫下,蓝藻细胞内EF-Tu的转录和蛋白水平均显著上调,而EF-G等其他翻译组分的水平则无明显变化。
EF-Tu水平的升高与蛋白质合成效率及PSII修复能力的增强密切相关,这表明上调EF-Tu是光合生物适应强光环境、保护翻译机器免受氧化损伤的关键策略。
四、叶绿体延伸因子(cpEF-Tu)
这种氧化还原调控机制在高等植物中同样存在,拟南芥细胞核基因组编码一个定位于叶绿体的EF-Tu(cpEF-Tu)。
cpEF-Tu中与蓝藻Cys82对应的保守位点是Cys149,该位点同样对H₂O₂敏感,被氧化后会导致翻译活性丧失。
叶绿体中主要的硫氧还蛋白Thioredoxin f1能够还原并重新激活氧化的cpEF-Tu,这证实了该调控机制在从蓝藻到高等植物的进化过程中是保守的。
总结
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
