
导读
多结构域蛋白在细胞内普遍存在,但其多个结构域组合在一起时,本质上容易发生折叠错误。为了确保正确折叠,细胞进化出了共翻译折叠机制,即蛋白质在核糖体上合成的同时进行折叠。
核糖体通过逐步折叠和相互作用,帮助新生肽链避免错误折叠。然而,核糖体如何调控多结构域蛋白的折叠,尤其是在多结构域蛋白更为普遍的真核生物中,其机制尚不清楚。
真核与原核生物的核糖体在新生肽链出口通道的结构上存在差异,这可能直接影响共翻译折叠的效率。因此,在分子水平上解析真核核糖体如何塑造多结构域蛋白的构象,对于理解蛋白质生物合成的效率至关重要。
2025年9月19日,英国弗朗西斯·克里克研究所David Balchin团队在Nature Structural & Molecular Biology上发表了题为“The human ribosome modulates multidomain protein biogenesis by delaying cotranslational domain docking”的论文。该研究发现人类核糖体通过一种独特的机制来调控多结构域蛋白的正确折叠,即在翻译过程中使已折叠的结构域界面保持动态平衡,延迟它们之间的稳定对接,直到翻译即将终止。

文章索引
【标题】The human ribosome modulates multidomain protein biogenesis by delaying cotranslational domain docking
【发表期刊】Nature Structural & Molecular Biology
【发表日期】2025年9月19日
【作者及团队】英国弗朗西斯·克里克研究所David Balchin团队
【IF】10.1
研究结果
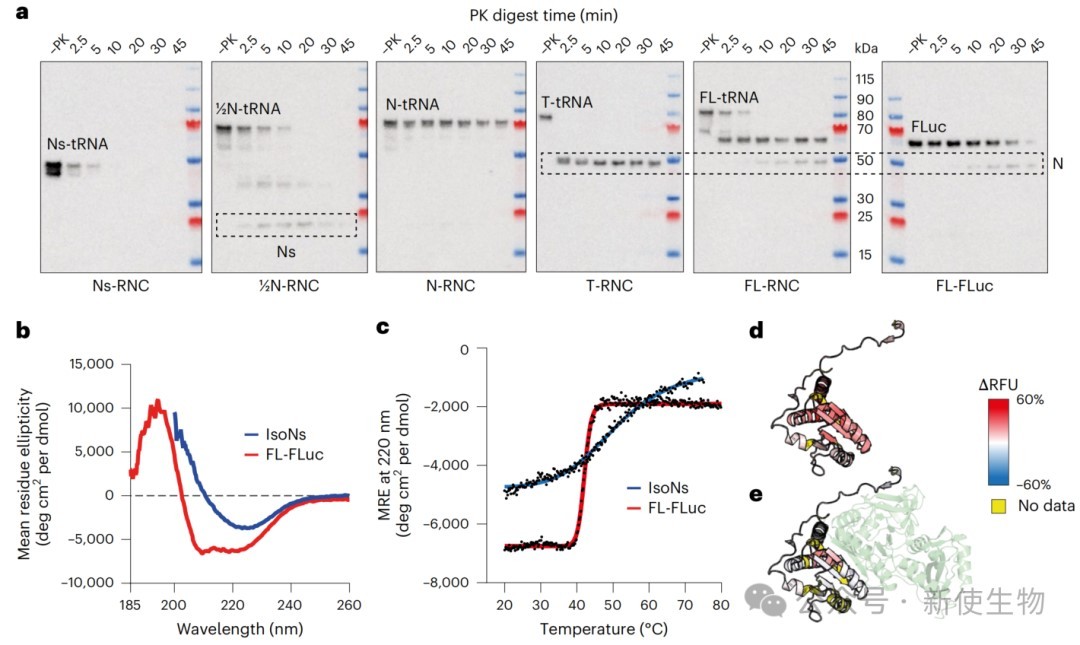
一、成功制备用于研究的萤火虫荧光素酶(FLuc)RNCs
研究人员设计了一系列FLuc蛋白的翻译停滞突变体,并在人类细胞中表达,成功纯化出不同翻译阶段的、均一且稳定的核糖体-新生肽链复合物(RNCs)。
这些高质量的RNCs为后续的氢氘交换质谱(HDX-MS)和冷冻电镜(cryo-EM)分析奠定了基础。
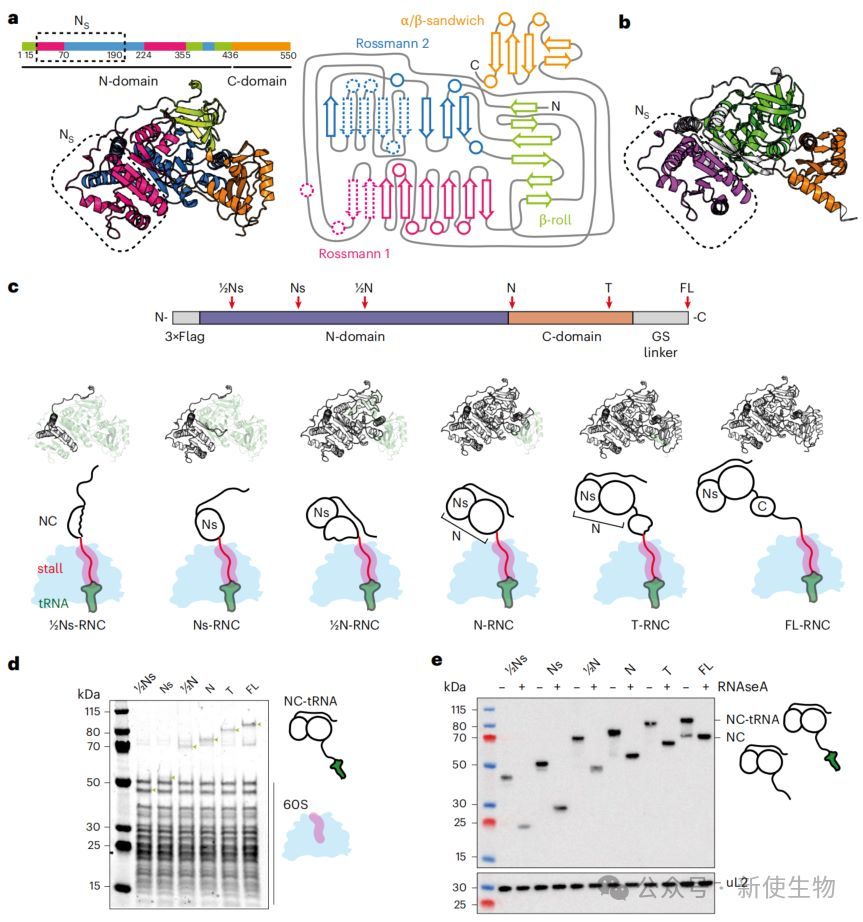
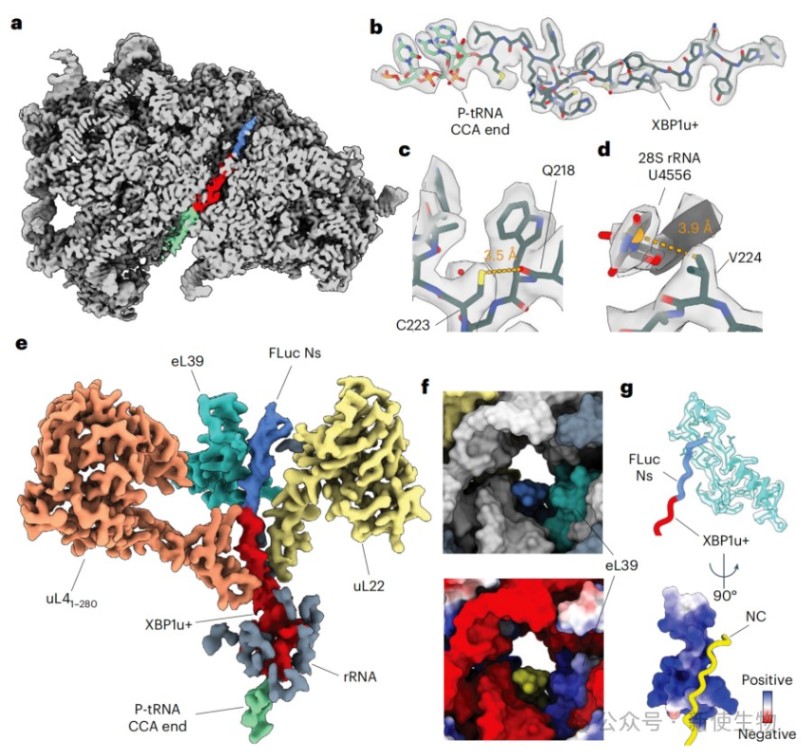
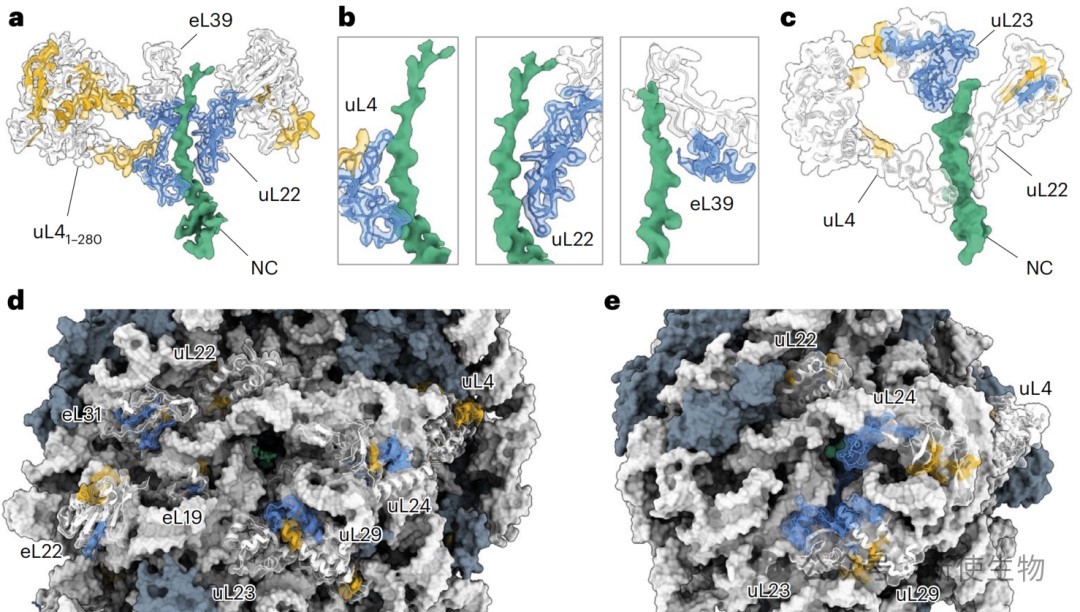
二、解析早期FLuc新生肽链在核糖体出口通道内的结构
通过cryo-EM解析了早期RNC(Ns-RNC)的高分辨率结构,揭示了翻译停滞序列如何与核糖体相互作用以暂停翻译。
同时,结构显示新生肽链在真核生物特有的出口通道蛋白eL39附近形成一个狭窄的沟槽内延伸,其构象受到通道环境的限制。
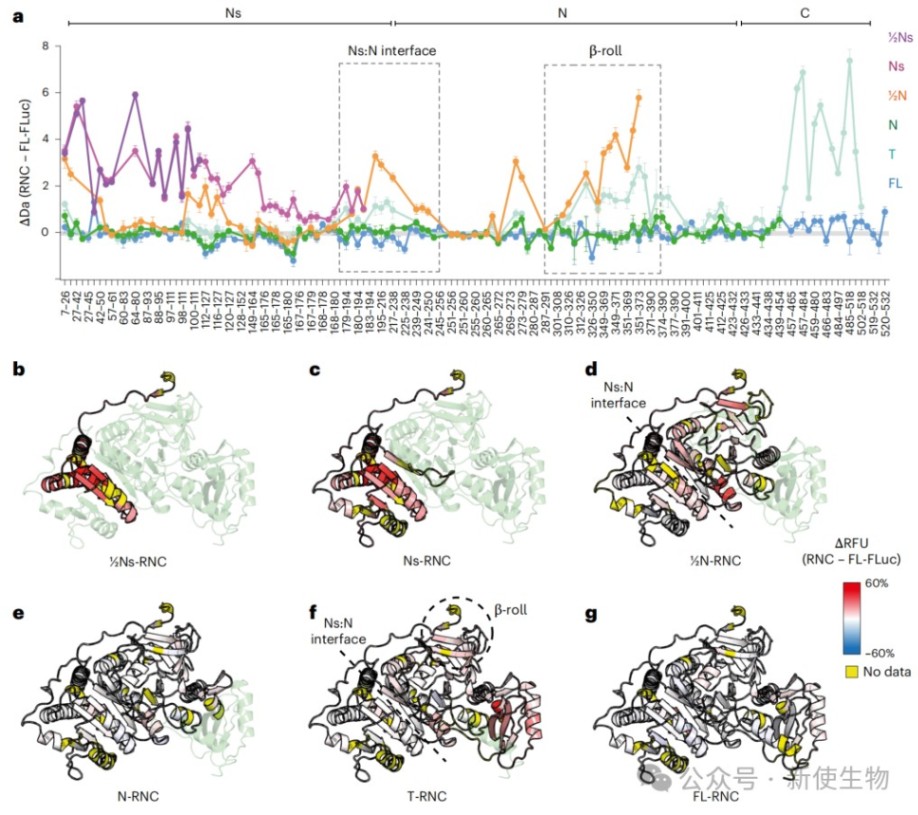
三、揭示FLuc在人类核糖体上逐步且动态的折叠过程
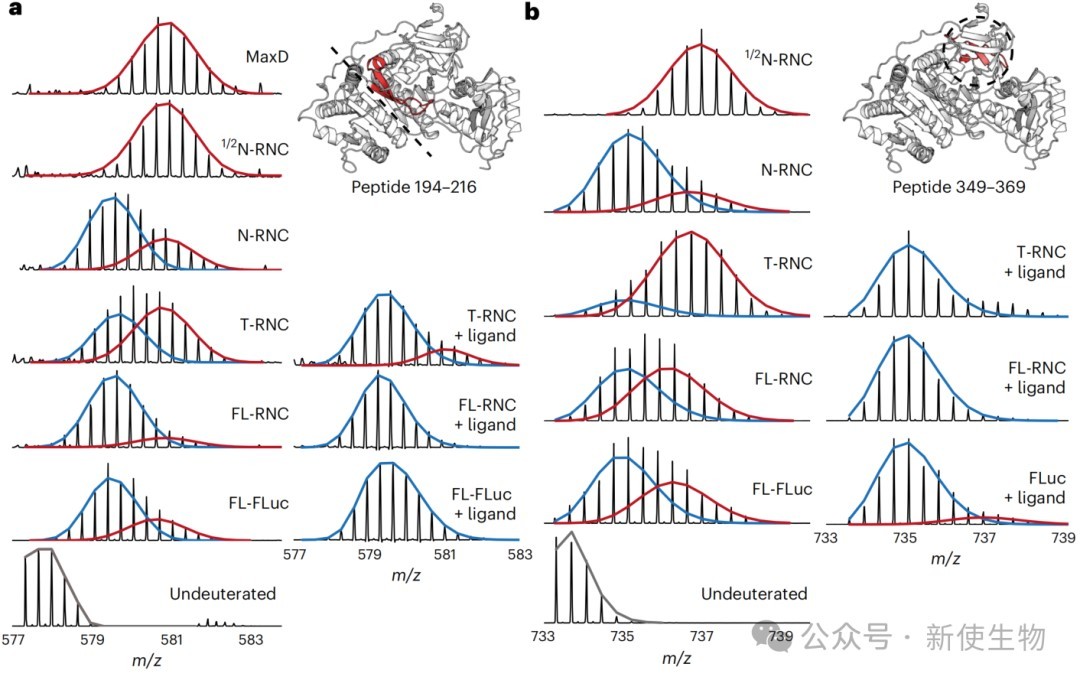
利用HDX-MS技术,研究追踪了FLuc在合成过程中不同片段的构象动态。
结果表明,FLuc的亚结构域(Ns)的折叠是延迟的,需要其相互作用的结构域伙伴被合成后才能稳定折叠。
然而,在翻译即将终止时,已经形成的N端结构域界面会发生一次去稳定化过程。
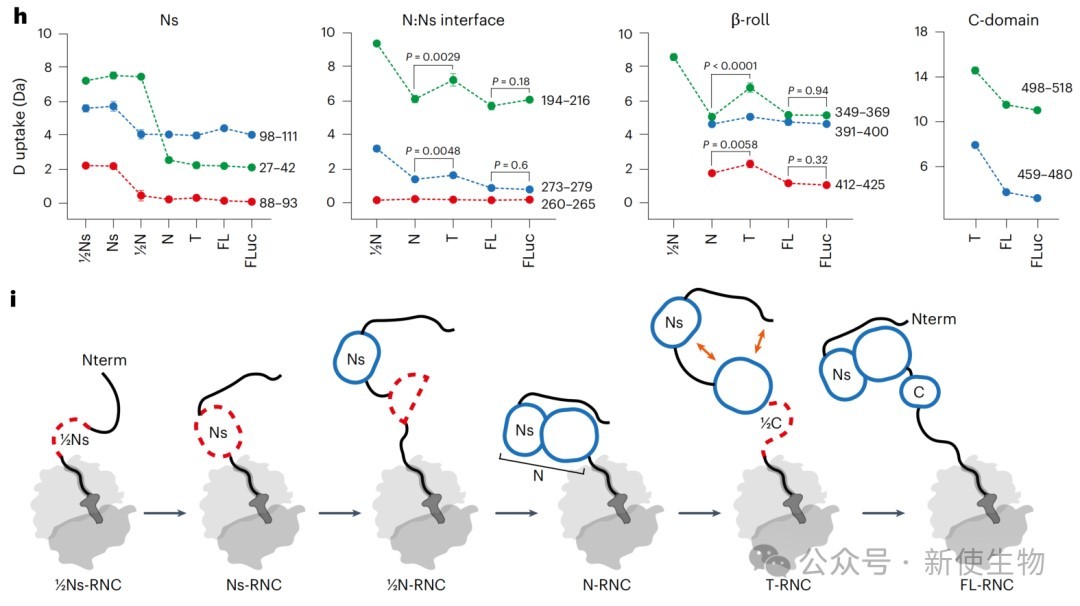
四、Ns亚结构域的折叠依赖于其伙伴结构域的共翻译合成
通过有限蛋白酶解和体外生化实验,研究证实了FLuc的Ns亚结构域自身不能独立折叠成稳定结构。
它的正确折叠完全依赖于在核糖体上与后续合成的N端结构域其他部分形成正确的天然界面,这进一步支持了其折叠被延迟的结论。
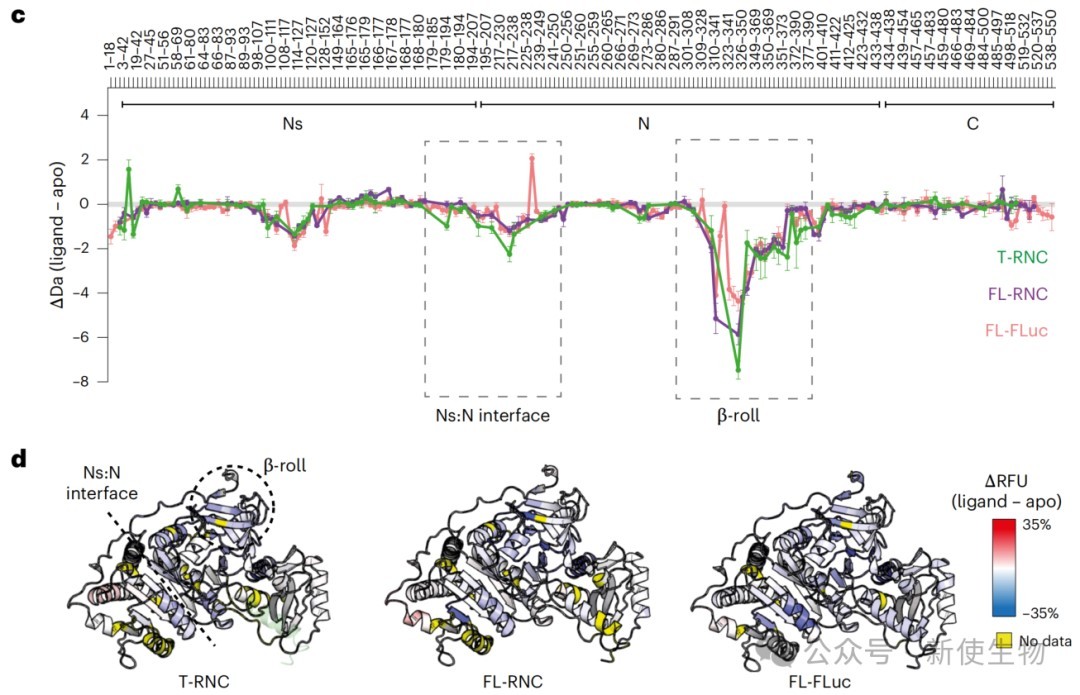
五、结构域界面在翻译终止前处于动态平衡
HDX-MS分析和配体结合实验表明,在翻译即将完成但C端肽链仍未完全伸展时,已形成的N端结构域界面并非稳定锁定,而是处于一种折叠(对接)和去折叠(解离)的动态平衡中。
六、人类与细菌核糖体在调控新生肽链构象上存在显著差异
通过对比在人类和细菌核糖体上合成的FLuc RNCs,研究发现两种核糖体对新生肽链的构象系综有截然不同的影响。
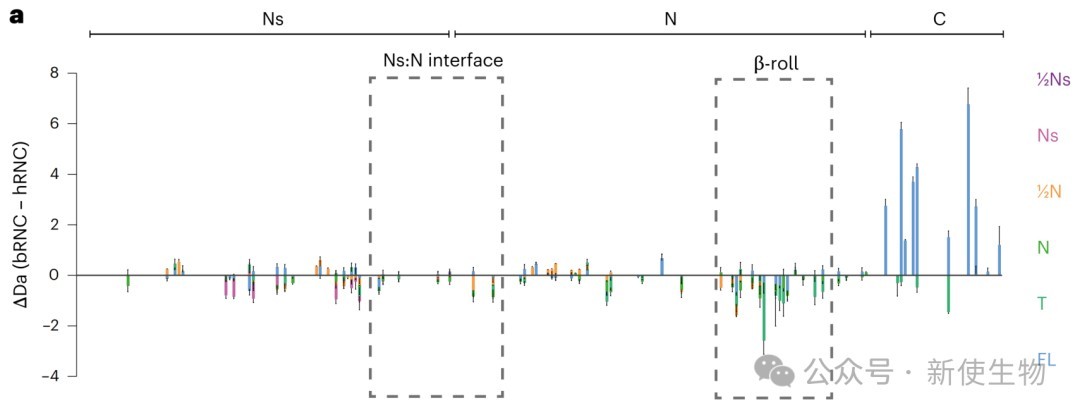
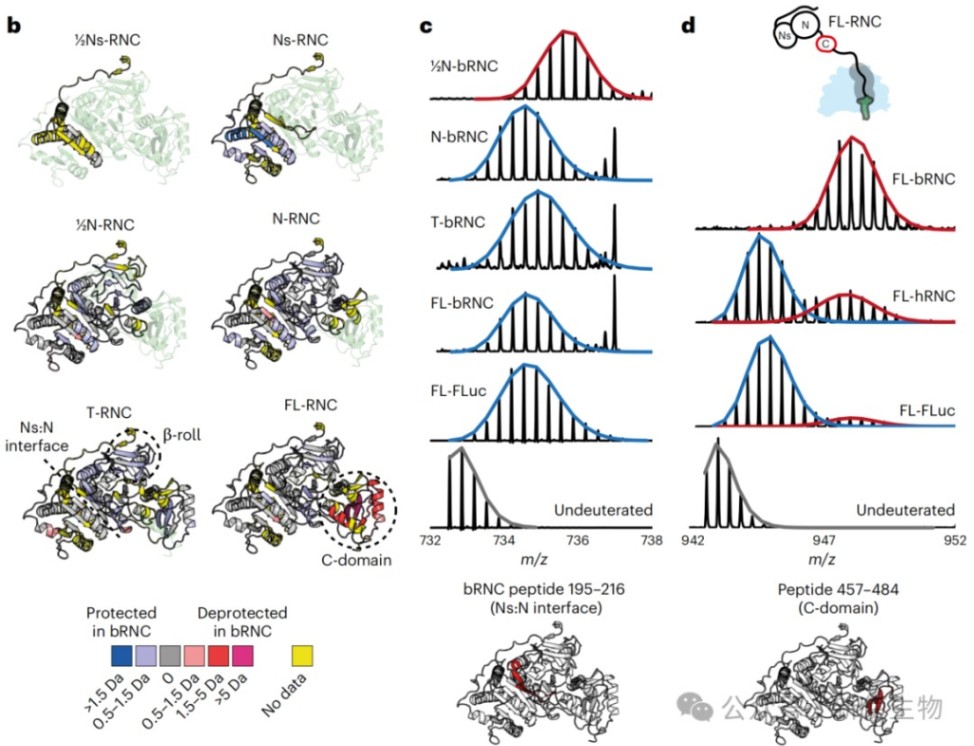
在细菌核糖体上,N端结构域的对接发生得更早且更稳定,但C端结构域的折叠却受到抑制,这些差异与两种核糖体表面与新生肽链相互作用的位点不同有关。
总结
本研究通过对真核生物共翻译折叠过程的深入解析,揭示了人类核糖体通过延迟结构域稳定对接,来主动调控多结构域蛋白生物合成的新机制。这一发现不仅解释了为何真核生物能高效合成其复杂的蛋白质组,也突显了核糖体本身作为折叠调控平台的物种特异性,为理解蛋白质质量控制提供了重要见解。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
