导读
多发性硬化症(MS)是中枢神经系统(CNS)中最常见的神经系统疾病之一。
在脱髓鞘的MS病变中,少突胶质细胞(OLs)的再髓化能力受阻。尽管过去认为再髓化失败是由于少突胶质细胞祖细胞(OPCs)分化缺陷所致,但最近的证据表明在MS病变中存在成熟的OLs,其未能正确再髓化轴突。目前尚不清楚阻止细胞再髓化的分子机制,也没有有效的治疗手段。
在成年脑中,对环境刺激的适应性髓鞘化对于获得新的运动技能和维持正常神经功能至关重要。选择性髓鞘的丧失导致各种神经退行性疾病和与衰老相关的认知功能下降的进展。然而,导致疾病和衰老中髓鞘再生受损的机制尚不清楚,这阻碍了有效治疗方法的发展。
表观遗传调节对各种发育和再生过程至关重要,并且是缓解年龄相关修复能力下降的一种有希望的方法。
目前科研人员已经付出了大量努力来寻找促进OPC分化的化合物,但对从成熟或分化的OLs诱导髓鞘产生的治疗药物的理解仍然有限。
2024年5月2日,美国俄亥俄州辛辛那提儿童医院医学中心Q. Richard Lu团队在Cell上发表了一篇题为“Small-molecule-induced epigenetic rejuvenation promotes SREBP condensation and overcomes barriers to CNS myelin regeneration”的论文,文章确定了OL髓鞘产生的表观遗传沉默屏障,并可通过小分子干预进行处理,为增强CNS髓鞘再生提供了潜在策略。


文章索引
【标题】Small-molecule-induced epigenetic rejuvenation promotes SREBP condensation and overcomes barriers to CNS myelin regeneration
【发表期刊】Cell
【发表日期】2024年5月2日
【作者及团队】美国俄亥俄州辛辛那提儿童医院医学中心Q. Richard Lu团队
【IF】66.85
研究结果
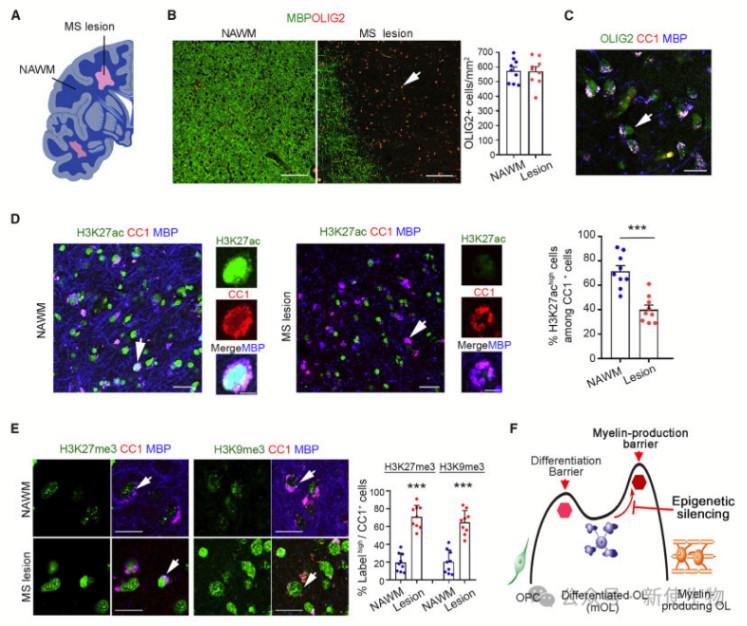
一. 多发性硬化症病变中的少突胶质细胞被表观遗传沉默且缺乏髓鞘产生
作者检查了多发性硬化症(MS)患者尸检组织切片,发现即使在没有髓鞘的病变中,OL谱系标记物OLIG2的表达与邻近的正常白质区域相似。大多数OLIG2+细胞也表达成熟OL标记物CC1,提示病变中存在成熟但无法产生髓鞘的OLs。
与正常白质相比,病变中的OLs显示出表观遗传抑制状态,表现为较低水平的转录激活标记物和较高水平的转录沉默标记物。这些观察结果表明,MS病变中的OLs存在表观遗传沉默,阻碍了髓鞘的产生。
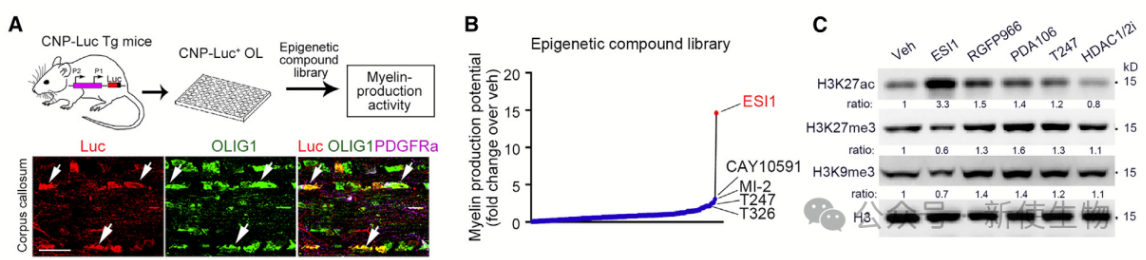
二. 小分子表观遗传沉默抑制剂的鉴定
为了找到增强OL髓鞘产生的抑制剂,作者创建了一个转基因小鼠系,携带了一个CNP启动子驱动的荧光素酶报告基因,用于标记体内的成熟OLs。
研究团队发现,一种名为ESI1的小分子化合物表现最佳,它能显著增强荧光素信号,是其他化合物的5倍左右。
ESI1最初被认为是HDAC3抑制剂,但实验证明它不仅能降低抑制性染色质标记物的水平,还能提高激活性标记物的水平。
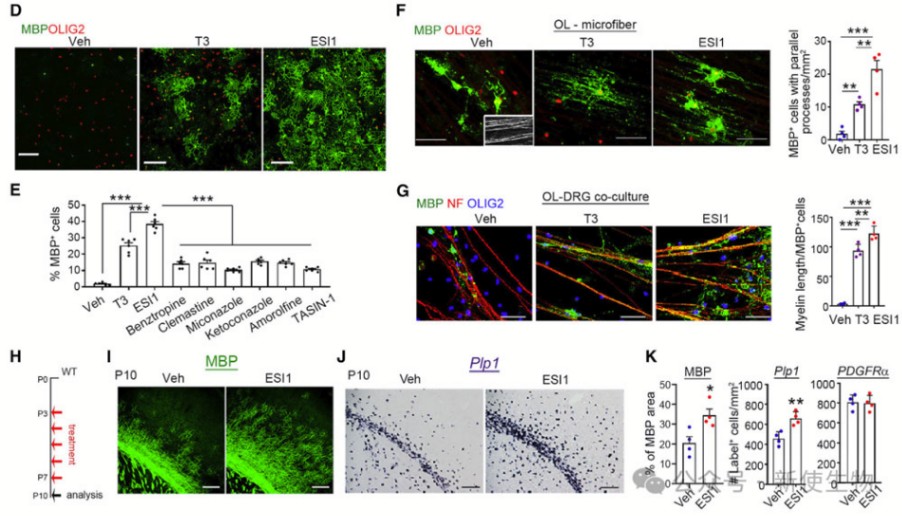
三. ESI1促进OL成熟和轴突包囊
作者测试了ESI1对从P5-P7皮层分离的O4+少突胶质细胞的影响。在细胞培养中,ESI1显著促进了成熟OL的形成,而对增殖性OPCs的影响较小。
在体外实验中,ESI1也能有效促进O4+前髓鞘OLs与模拟轴突的微纤维的髓鞘形成。
在动物实验中,给予幼仔ESI1处理后,其大脑中MBP+髓鞘区域和Plp1+成熟OLs显著增加。这些结果表明ESI1能够在培养和发育的大脑中促进OL成熟。
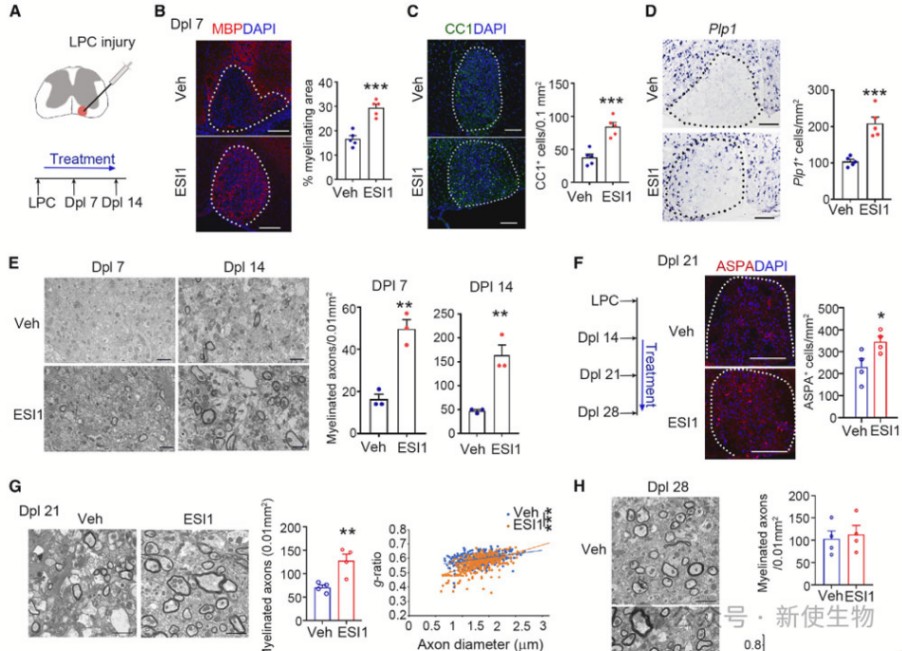
四. ESI1促进去髓鞘损伤后的再髓鞘化
从损伤后第2天开始,研究团队持续治疗至第7天,Dpl 7,ESI1处理组显示了显著增加的MBP+区域和更多的成熟OLs。电子显微镜显示,ESI1处理组的髓鞘轴突数量显著增加。
在再髓鞘化阶段开始治疗后,ESI1处理组显示了更多的成熟OLs和更厚的髓鞘。这些结果表明,ESI1在促进再髓鞘化和增加髓鞘厚度方面具有显著效果。
五. ESI1治疗促进了再生的中枢神经系统轴突上的新生髓鞘形成
成年小鼠视神经损伤模型中,轴突再生但无髓鞘形成。
通过AAV-OIC注射促进轴突再生,28天后ESI1处理组显示出显著增加的新成熟OL数量,以及仅在ESI1组中观察到的再生轴突的新髓鞘形成。
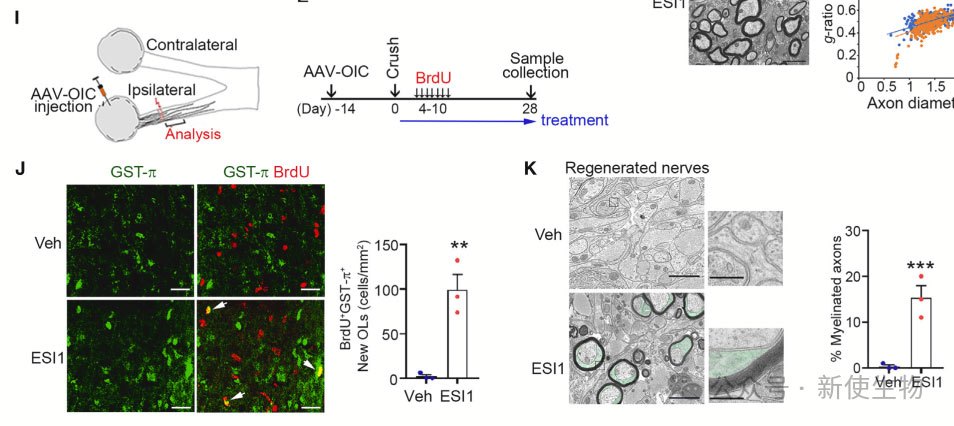
六. ESI1增强了EAE小鼠的再髓鞘化并减少了与疾病相关的表型
MOG35-55诱导的EAE小鼠模型表明,ESI1的治疗能够减轻疾病严重程度,增加成熟OL数量,降低脱髓区域内疾病相关OL数量,并促进脊髓中的再髓鞘化。ESI1还降低了免疫细胞浸润,并提高了脊髓中再髓鞘的轴突数量和髓鞘厚度。
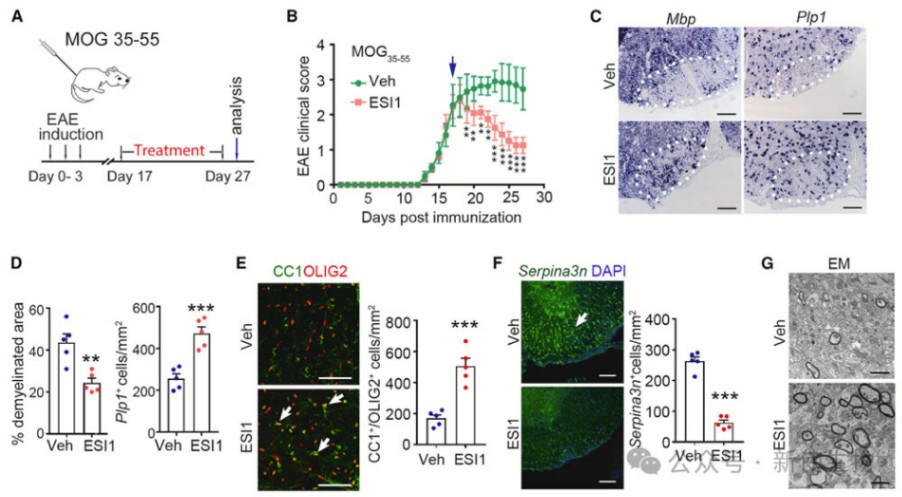
七. ESI1改善了EAE小鼠的神经功能恢复
在电生理测试中,ESI1处理组的脊髓神经传导活性与天然小鼠相似,而处理组表现出较低的信号。
在行为测试中,ESI1处理组表现出更好的运动性能。此外,ESI1治疗还改善了视觉功能,降低了炎症性脱髓病变,促进了再髓鞘形成。这些结果表明ESI1可能有助于提高EAE小鼠的临床症状和功能恢复。
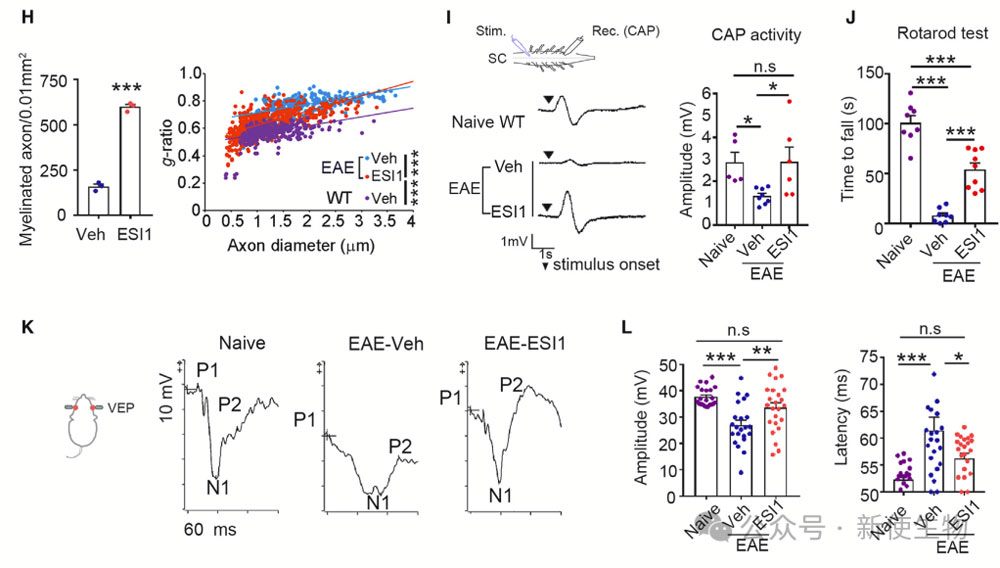
八. ESI1上调髓鞘生成转录组并重塑OL代谢
ESI1处理的O4+ OLs显示出独特的基因响应模式,促进了成熟OL的形成和髓鞘生成相关基因的表达,这些基因涉及胆固醇生物合成、脂质代谢和细胞骨架。ESI1还通过促进脂质代谢和髓鞘相关代谢物的积累来重编程OL代谢。
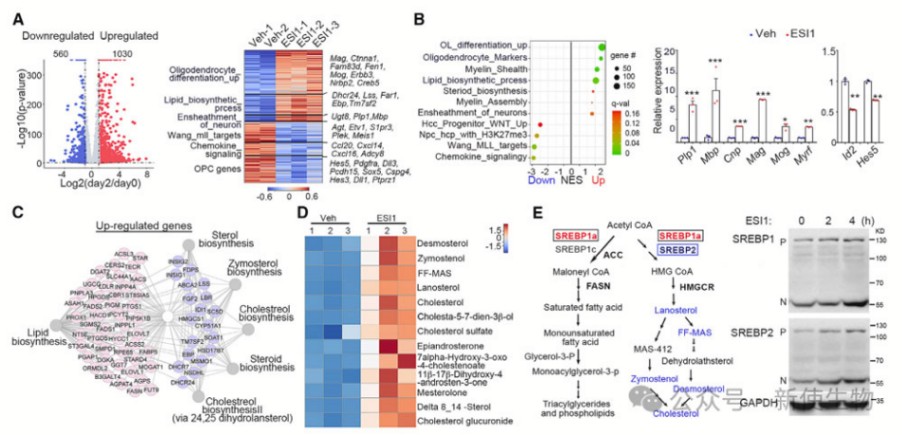
九. ESI1诱导SREBP1/2核凝聚以推动脂质和胆固醇生物合成
ESI1诱导SREBP1/2聚集在细胞核内,增强脂质和胆固醇的合成。这种聚集依赖于它们的乙酰化状态,通过促进转录机器的集中来激活相关基因。
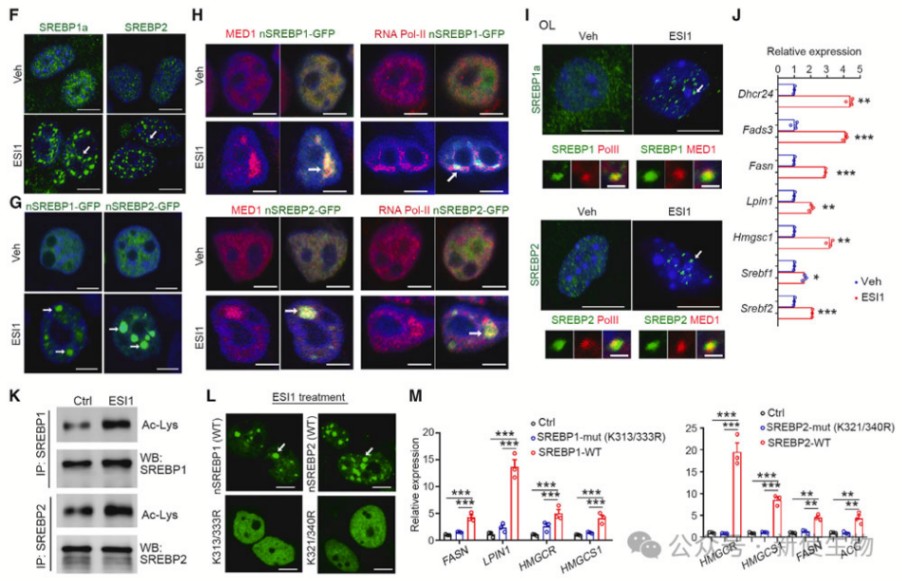
十. ESI1治疗诱导活跃的染色质景观,促进髓鞘形成程序
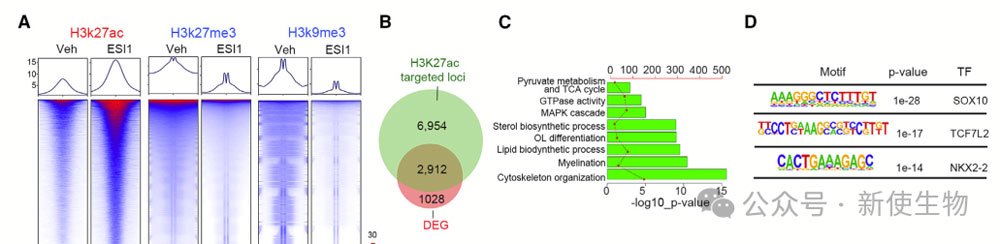
对O4+ OLs进行了CUT&RUN-seq分析,作者发现ESI1处理增加了H3K27ac信号,减少了H3K27me3和H3K9me3信号。ESI1处理导致2912个基因的表达变化,涉及髓鞘形成、脂质和固醇生物合成等。
H3K27ac标记的增强子在ESI1处理的细胞中富集了促进OL成熟的调节因子结合位点,表明ESI1可能通过增强调节因子在增强子位点上的合作来促进OL成熟。
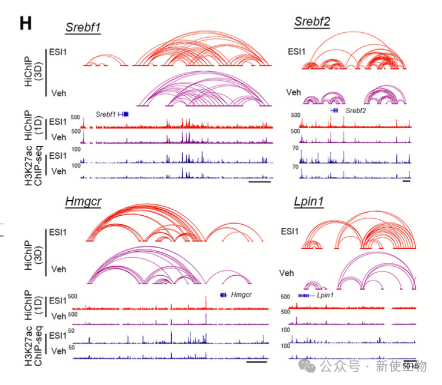
十一. ESI1促进髓鞘形成基因转录的长距离增强子-启动子相互作用
ESI1治疗增强了H3K27ac信号,标记了超级增强子簇。ESI1治疗诱导了长距离增强子/启动子环路的显著增加,促进了脂质/胆固醇生物合成关键基因和髓鞘形成调节基因的表达。

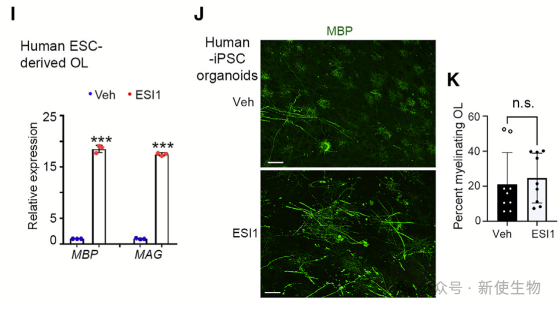
十二. ESI1在人类器官样结构中增加了髓鞘长度
ESI1提高了人类胚胎干细胞(ESC)衍生的OL前体的表达,诱导了髓鞘相关基因的表达。在人类诱导多能干细胞(iPSC)衍生的髓鞘器官样体中,ESI1处理导致髓鞘长度延长。
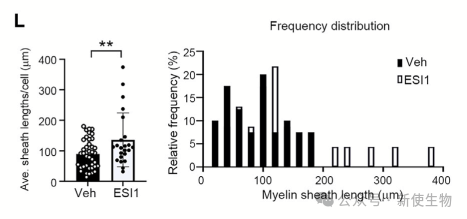
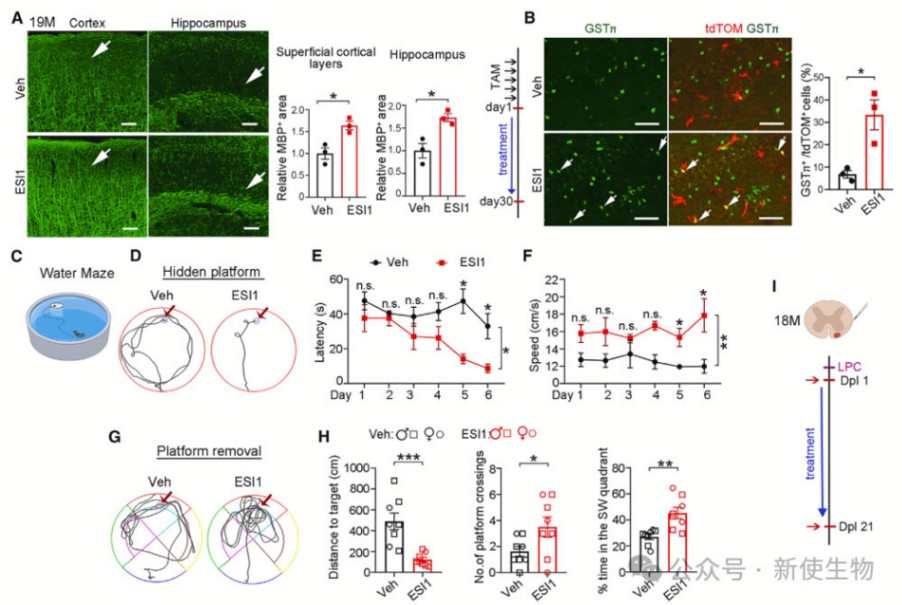
十三. ESI1改善了老年小鼠的髓鞘下降和认知缺陷,并增强了髓鞘形成
作者使用Morris水迷宫测试发现,接受ESI1治疗的老年小鼠在找到隐藏平台上更快,游泳速度更快,且在平台移除后更快找到目标象限。这些结果表明,ESI1治疗不仅改善了认知功能,还提高了运动能力。
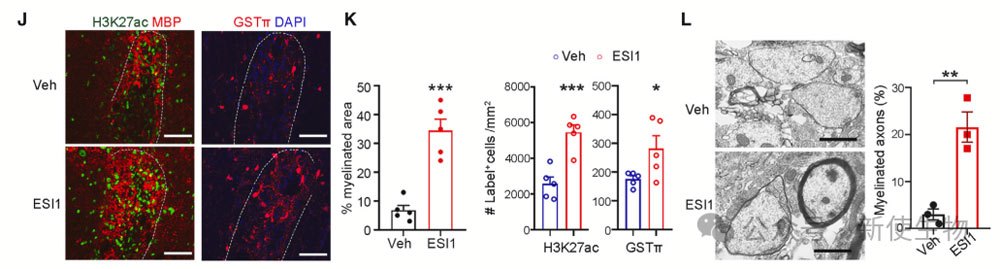
十四. ESI1治疗增强老年小鼠受伤后的再髓鞘化
18至19个月的老年小鼠接受ESI1治疗后,损伤部位的MBP+面积和GST-p+成熟OL的数量增加,H3K27ac标记的细胞数量也上升。
超微结构分析显示,ESI1治疗的老年小鼠髓鞘化的轴突增加。这表明,ESI1治疗能增强老年小鼠在脱髓鞘性损伤后的再髓鞘化。
总结
该研究揭示了多发性硬化等疾病中再髓鞘化失败的新机制,找到了ESI1,一种小分子药物,可以促进髓鞘生成和修复。
ESI1不仅在动物模型中促进了再髓鞘化,还使再生的神经系统轴突重新生成髓鞘。此外,ESI1治疗还延长了人体器官样体中的髓鞘,促进了老年小鼠的髓鞘修复,并逆转了与年龄相关的认知衰退。
了解更多ribo seq,翻译组联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们