
导读
胰腺导管腺癌(PDAC)是一种高度致命的恶性肿瘤,其发生发展受到KRAS基因突变和包括SRSF1、MYC和AURKA在内的多种癌基因调控。尽管针对KRAS靶点的疗法正在开发中,但耐药机制的出现凸显了寻找替代性治疗靶点的重要性。
SRSF1在PDAC进展中起着重要作用,其表达受MYC驱动的转录激活调控。MYC是一种有效的癌基因转录因子,在PDAC中经常被扩增,并且与KRAS抑制剂耐药有关。
AURKA是一种必需的有丝分裂丝氨酸/苏氨酸激酶,在包括PDAC在内的多种癌症中经常过度表达。AURKA的旁系同源物AURKB也具有致癌性。AURKA的过表达足以驱动细胞转化,但其激酶抑制剂的临床疗效有限,这可能是由于AURKA具有不依赖于激酶活性的核内作用。
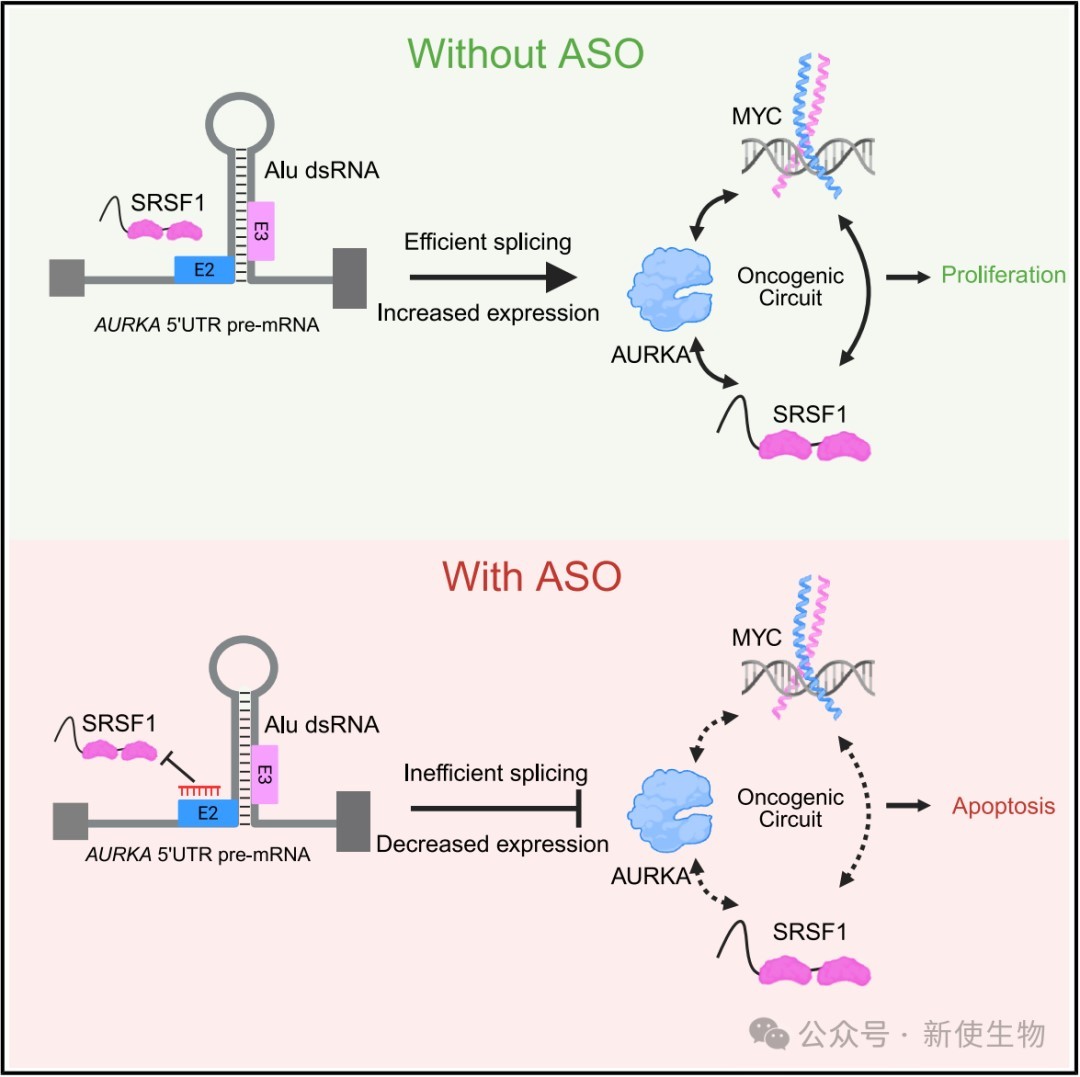
2026年1月8日,冷泉港实验室Adrian R. Krainer团队在Molecular Cell上发表了一篇题为“Splice-switching ASOs targeting the AURKA 5′ UTR collapse an SRSF1-AURKA-MYC oncogenic circuit in pancreatic cancer”的论文。该研究揭示了SRSF1、AURKA和MYC之间存在一个致癌环路,其中SRSF1通过调控AURKA 5' UTR的选择性剪接来增强AURKA的表达。

文章索引
【标题】Splice-switching ASOs targeting the AURKA 5′ UTR collapse an SRSF1-AURKA-MYC oncogenic circuit in pancreatic cancer
【发表期刊】Molecular Cell
【发表日期】2026年1月8日
【作者及团队】冷泉港实验室 Adrian R. Krainer 团队
【IF】16.6
研究结果
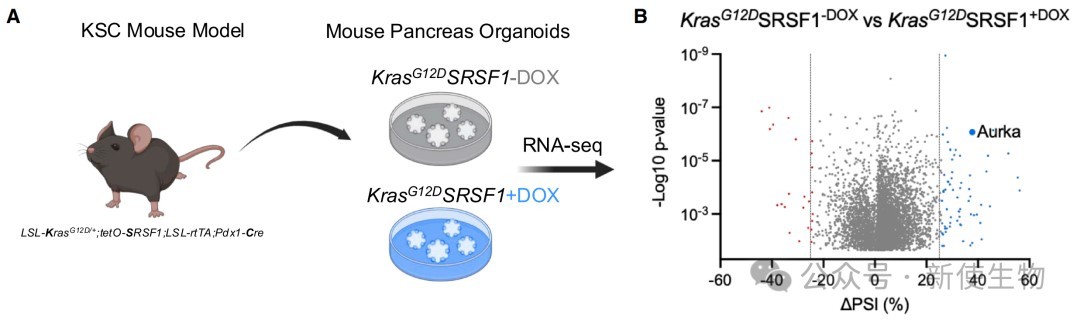
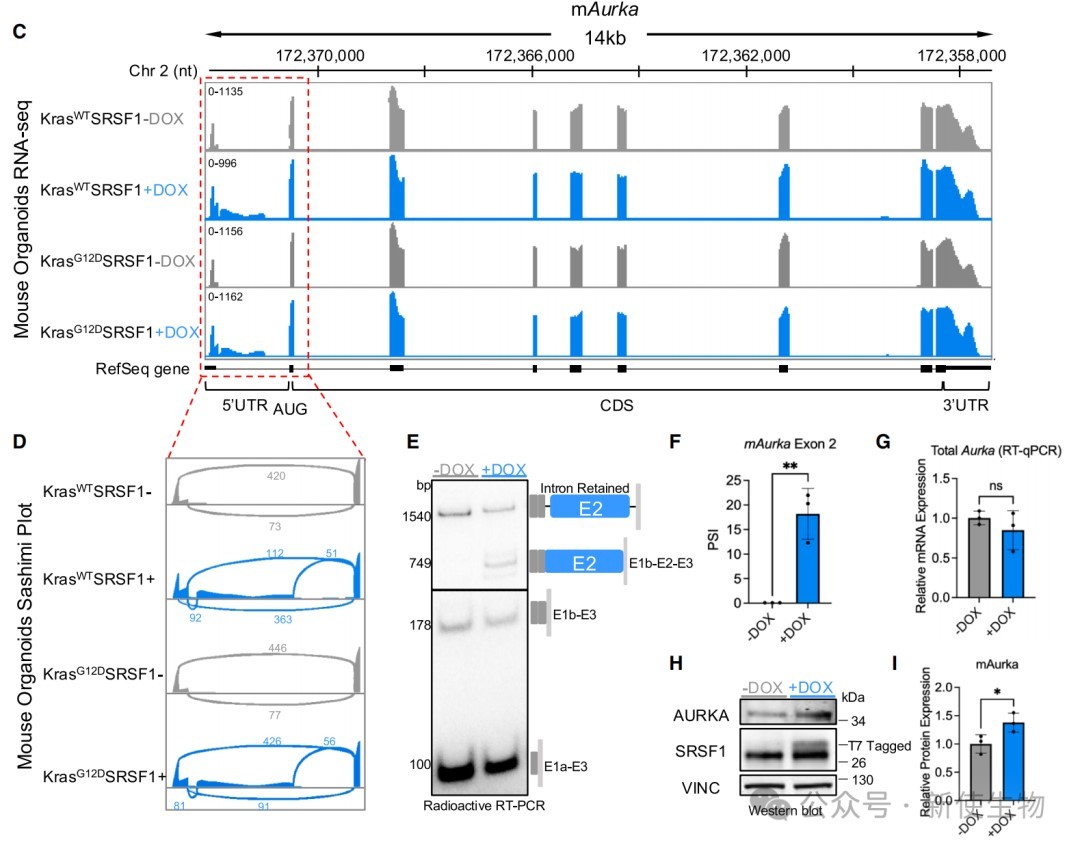
一、SRSF1调控小鼠Aurka 5' UTR的剪接
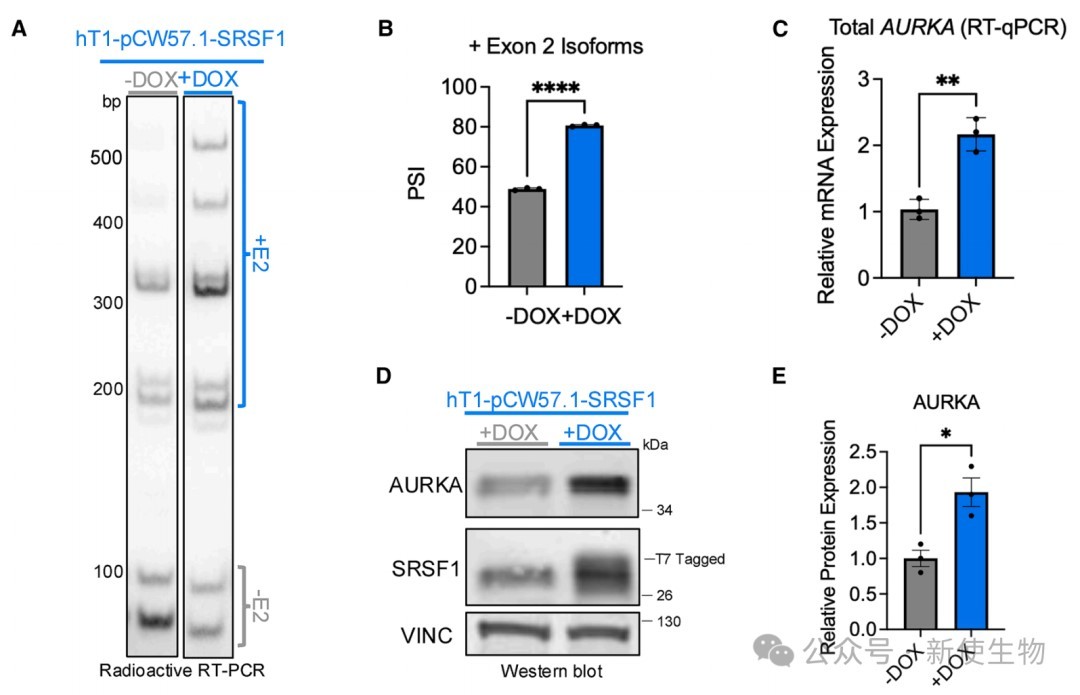
通过在小鼠胰腺癌类器官模型中过表达SRSF1,发现SRSF1诱导了Aurka基因5' UTR中一个新外显子2的包含事件。
尽管总mRNA水平未变,但AURKA蛋白水平显著升高,提示该剪接事件增强了蛋白表达。
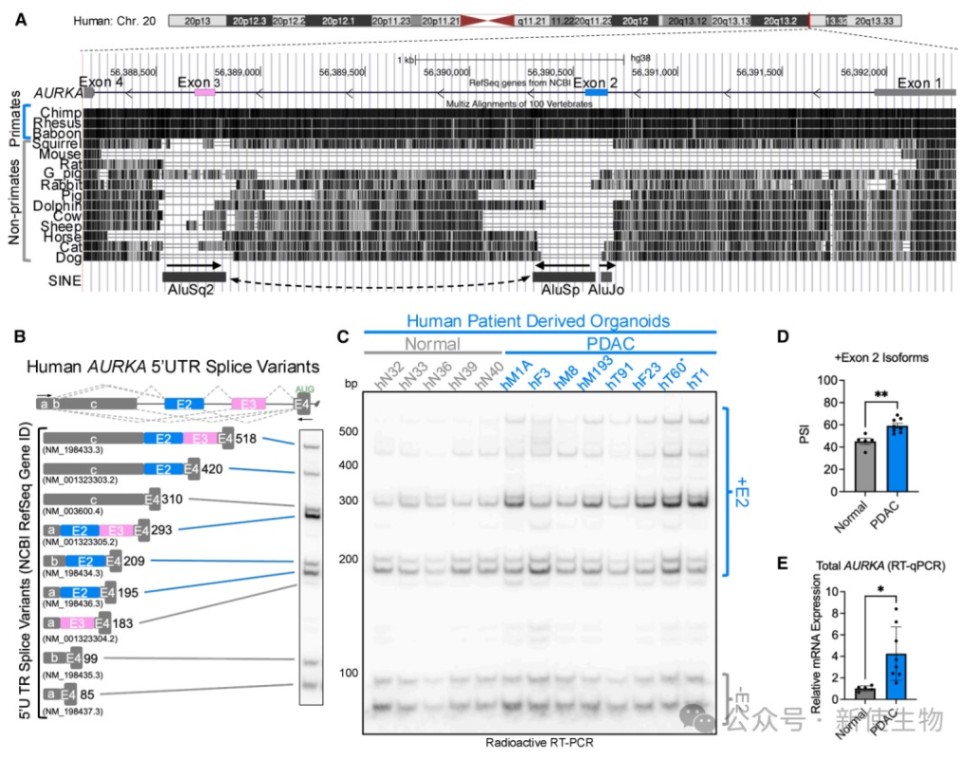
二、人源AURKA 5' UTR包含两个Alu来源的上调外显子
通过序列分析和对比正常与PDAC病人来源的类器官,发现人源AURKA外显子2和3是Alu元件外显子化的产物。
包含外显子2的(+E2)异构体在PDAC类器官中表达显著上调,且与AURKA总mRNA水平升高相关。
三、SRSF1在人源PDAC类器官中调控AURKA剪接
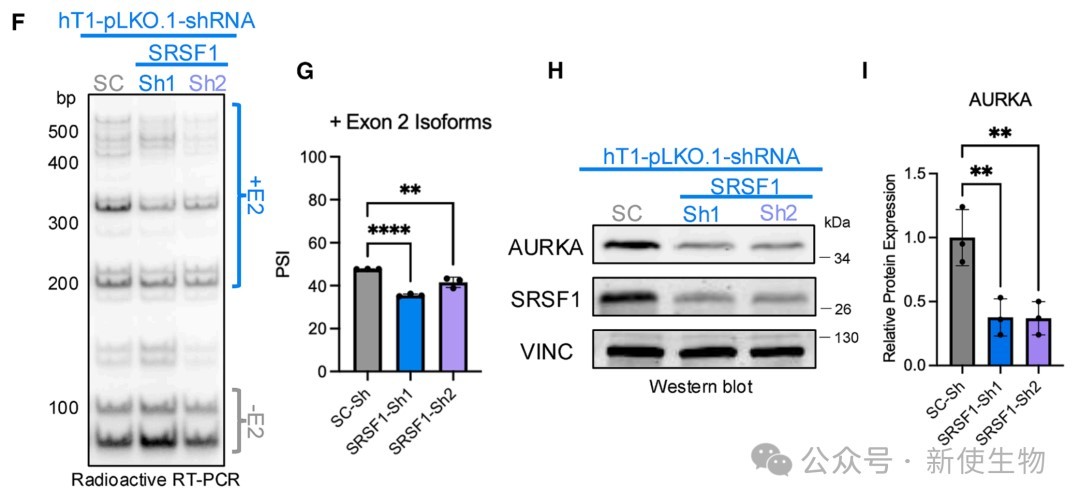
在人源PDAC类器官中过表达或敲降SRSF1,证实了SRSF1直接调控人源AURKA的剪接。
SRSF1过表达促进外显子2的包含并上调AURKA蛋白,反之则抑制外显子2包含并降低AURKA蛋白。
四、AURKA 5' UTR的可变剪接通过剪接依赖机制增强蛋白表达
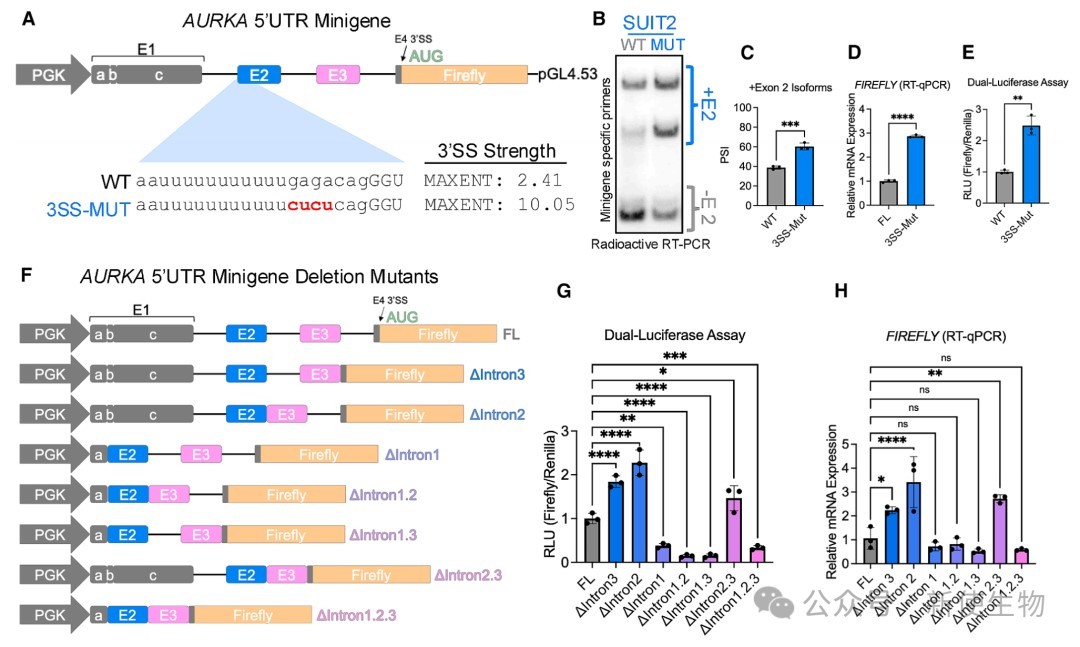
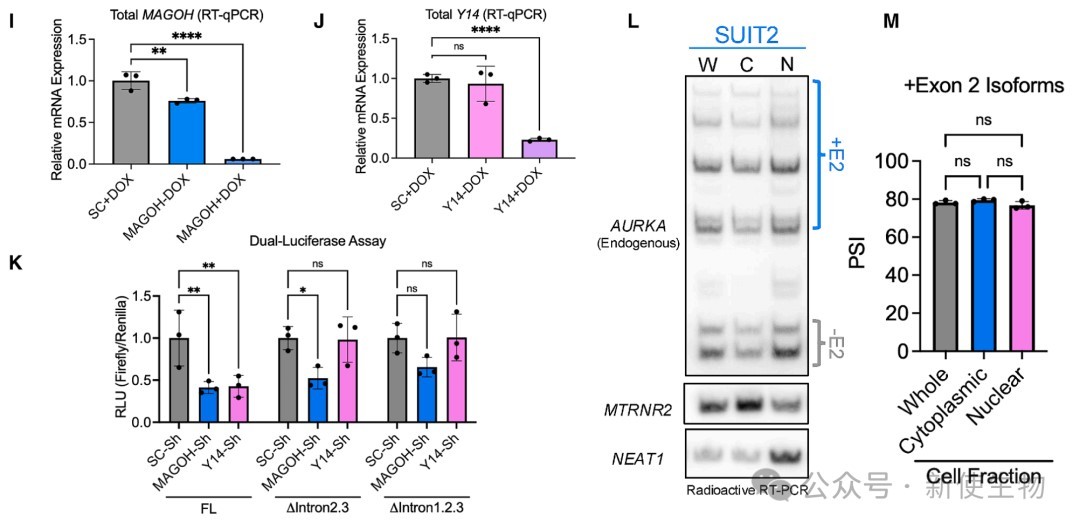
利用荧光素酶报告基因和微基因系统进行研究,发现包含外显子2的剪接事件通过促进mRNA积累和外显子连接复合物(EJC)的沉积来增强蛋白翻译。
这是一种不依赖于mRNA序列本身、而依赖于剪接过程的增强机制。
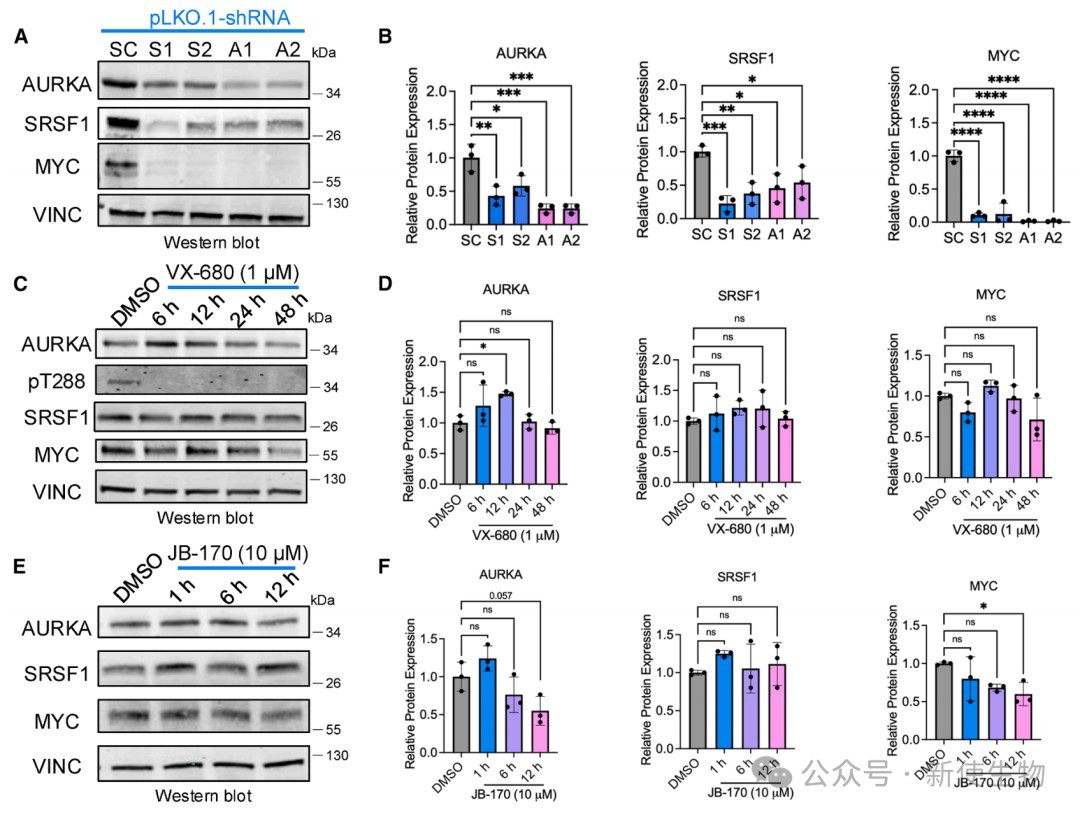
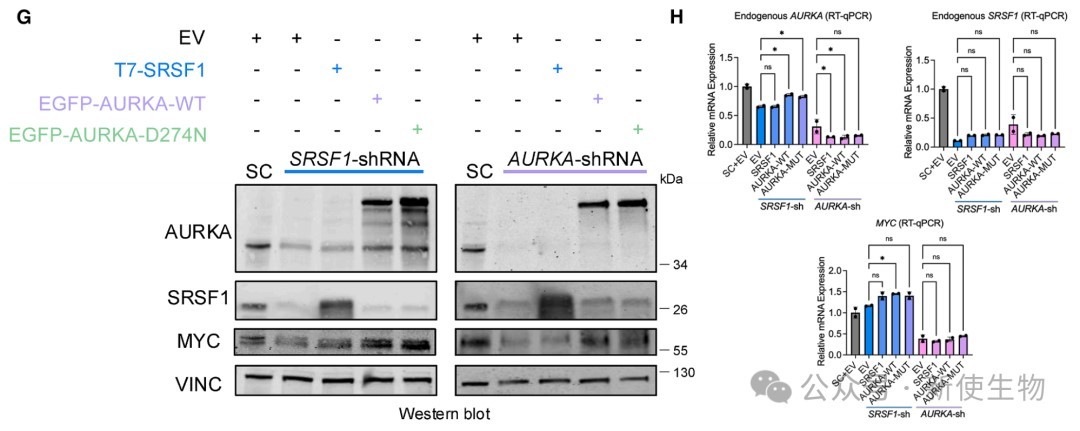
五、SRSF1-AURKA-MYC环路的维持依赖于AURKA蛋白而非其激酶活性
通过使用shRNA敲降、激酶抑制剂和PROTAC蛋白降解剂,证明了敲降SRSF1或AURKA会同时降低三者的蛋白水平。
重要的是,该环路的维持依赖于AURKA蛋白本身的存在,而非其激酶活性。
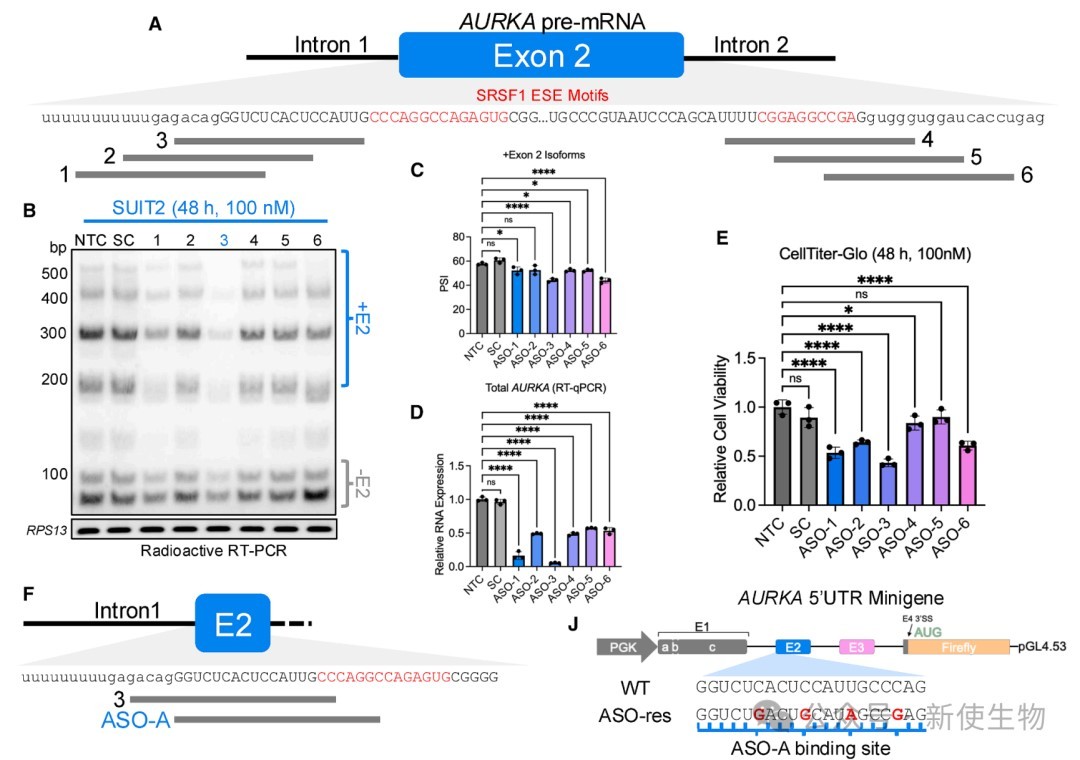
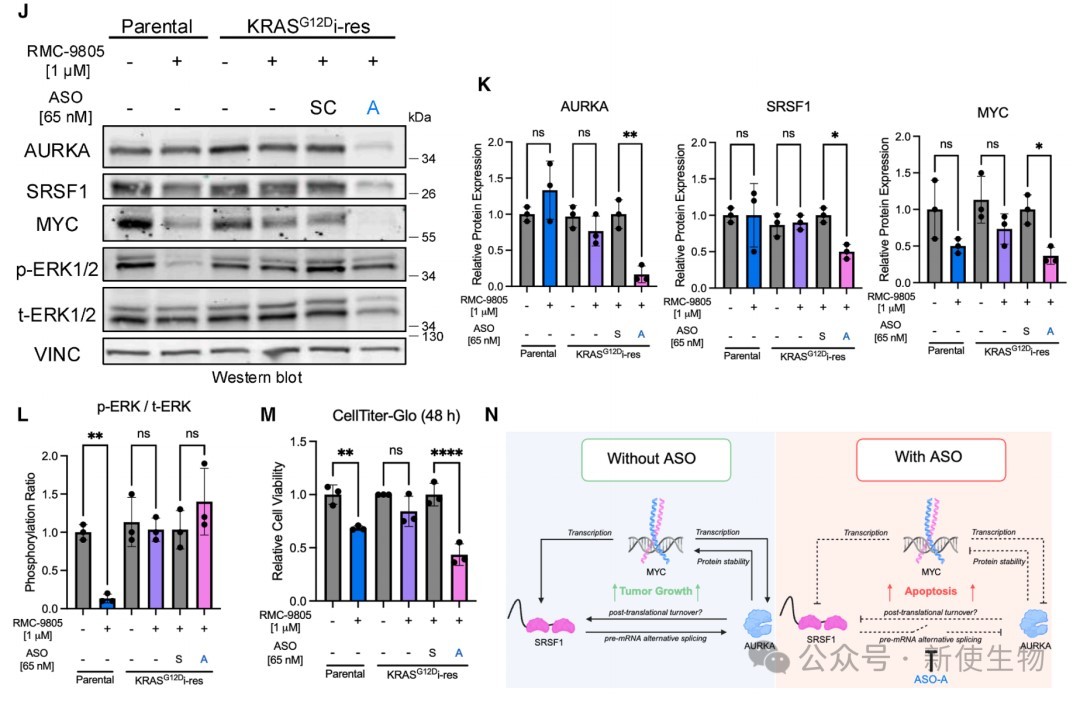
六、靶向外显子2的ASO能有效诱导其跳跃并降低AURKA表达
设计并筛选了多种靶向外显子2的剪接开关ASO,鉴定出一种高效的先导ASO(ASO-A)。
ASO-A能特异性诱导外显子2跳跃,并显著降低AURKA总mRNA水平和蛋白水平,从而抑制癌细胞活力。

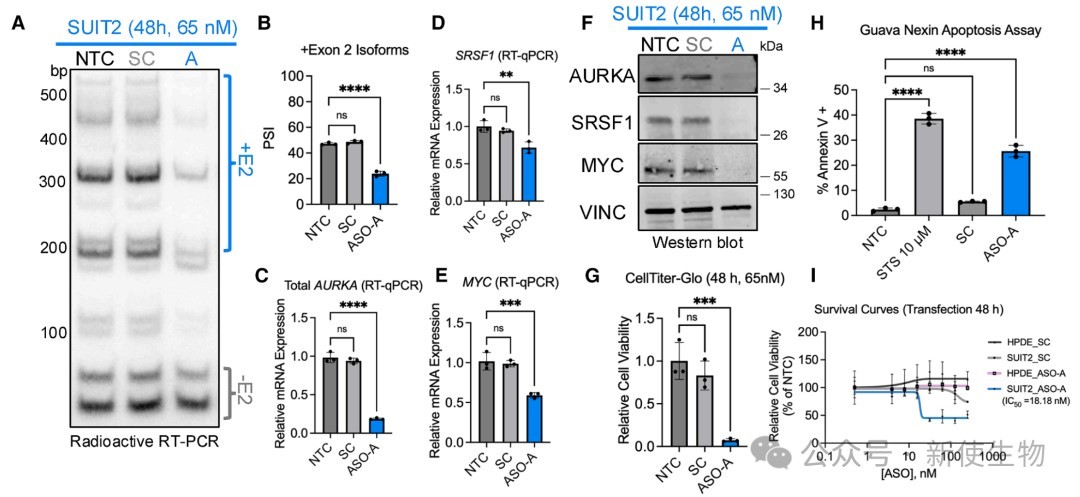
七、ASO-A能瓦解致癌环路、诱导凋亡并克服耐药性
在PDAC细胞系中应用ASO-A,发现它能有效瓦解SRSF1-AURKA-MYC致癌环路、诱导细胞凋亡。
此外,ASO-A在对KRAS G12D抑制剂产生耐药性的细胞中依然保持强大的抗肿瘤活性,显示出巨大的临床应用潜力。
总结
本研究系统地揭示并验证了胰腺癌中一个由SRSF1-AURKA-MYC构成的、由可变剪接维持的关键致癌环路。研究团队基于这一机制设计的剪接开关ASO,通过精准干预AURKA的剪接过程,成功瓦解了这一顽固的致癌网络,为开发靶向RNA的胰腺癌精准疗法提供了坚实的理论基础和极具转化前景的候选药物。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
