导读
开发合成基因表达调节器,如CRISPR-Cas系统和合成sRNA,使得高通量筛选基因并改造微生物代谢途径成为可能:
A)失活的Cas9(dCas9)或Cas12(dCas12)可特异性结合双链DNA,阻断转录并沉默基因表达
B)合成sRNA与Hfq蛋白一起结合mRNA,用于在翻译水平抑制基因表达。
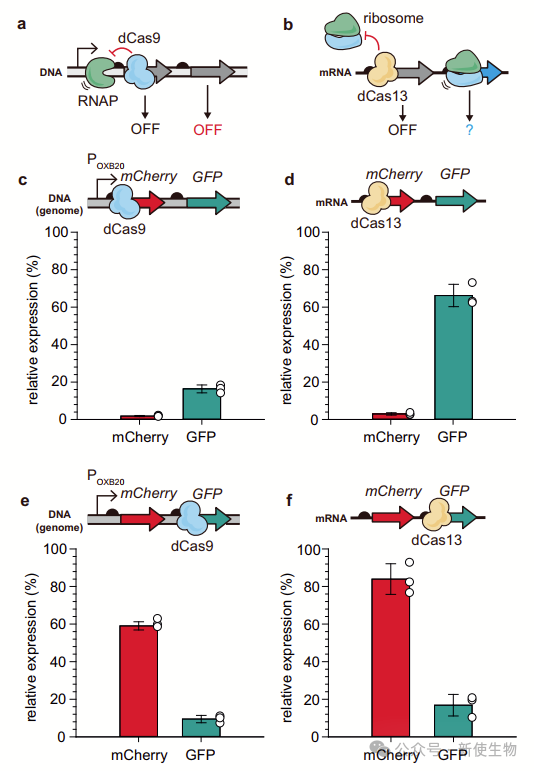
Cas13不同于Cas9和Cas12,它可以特异性切割单链RNA。虽然Cas13的活性状态会导致邻近RNA的非特异性降解,限制了其作为基因敲降工具的应用,但失活状态的Cas13(dCas13)可以通过隔离mRNA翻译起始区来抑制基因表达,但不影响细胞生长。
此外,通过将翻译起始因子融合到dCas13上,在翻译水平上实现了基因激活。
然而,dCas13的基因敲降或激活仅在单顺反子基因的简单开/关调控中进行了测试。作为合成基因表达调节器,dCas13的特异性或多重性等特性尚未详细研究。缺乏可以适度调节dCas13基因表达的策略限制了其在细菌细胞中的应用,无法与其他特征良好的合成基因调控系统相提并论。
2024年6月22日,首尔国立大学化学与生物工程学院Sang Woo Seo团队在Nature Communications上发表了一篇题为“Tunable translation-level CRISPR interference by dCas13 and engineered gRNA in bacteria”的论文,文章开发了基于dCas13的可调节Tl-CRISPRi系统,能精确调节不同细菌中多种基因的翻译水平,该系统有望成为细菌中一种稳健且可预测的翻译水平基因调控工具。

文章索引
【标题】Tunable translation-level CRISPR interference by dCas13 and engineered gRNA in bacteria
【发表期刊】Nature Communications
【发表日期】2024年6月22日
【作者及团队】首尔国立大学化学与生物工程学院Sang Woo Seo团队
【IF】16.6
研究结果
一. 基于dCas13的Tl-CRISPRi系统的设计与探索
通过基因组挖掘,作者选择了四种Cas13同源物并生成dCas13蛋白。实验显示,只有dRfxCas13d显著降低了mCherry基因表达至2.8%,且对细菌生长无影响,故团队选择dRfxCas13d构建Tl-CRISPRi系统。
验证结果显示,Tl-CRISPRi能在染色体不同位置有效敲降基因,并特异且同时抑制多个基因。
Tl-CRISPRi也能高效抑制质粒转录的mRNA翻译,且转录速率对表达水平影响不大。
研究还显示,Tl-CRISPRi适度减少目标mRNA数量,通过阻止翻译起始位点隔离核糖体,实现基因抑制。
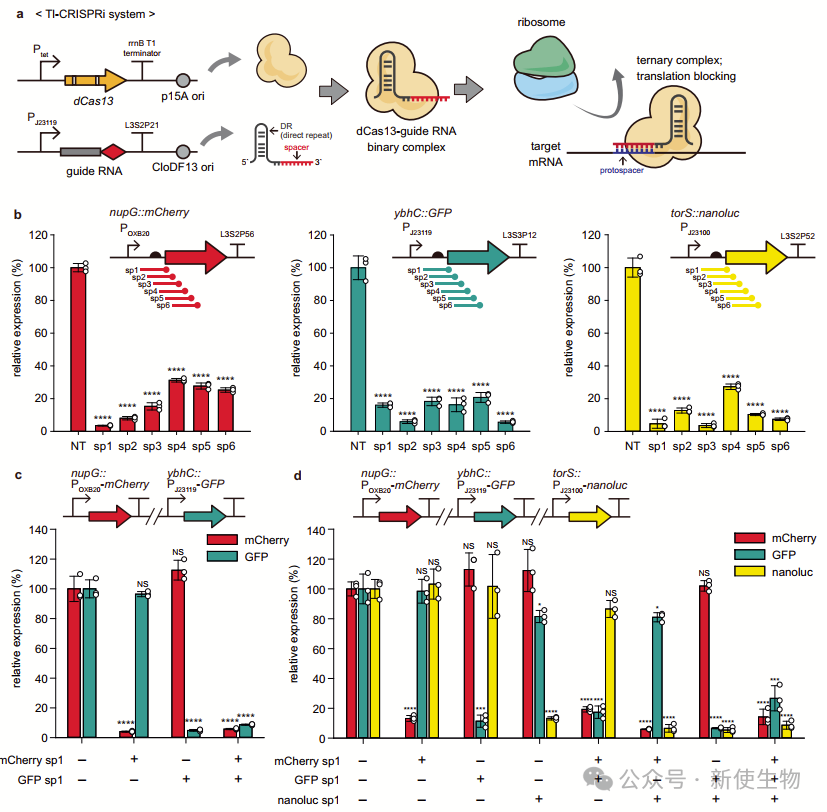
二. 通过Tl-CRISPRi调节多顺反子操纵子的表达
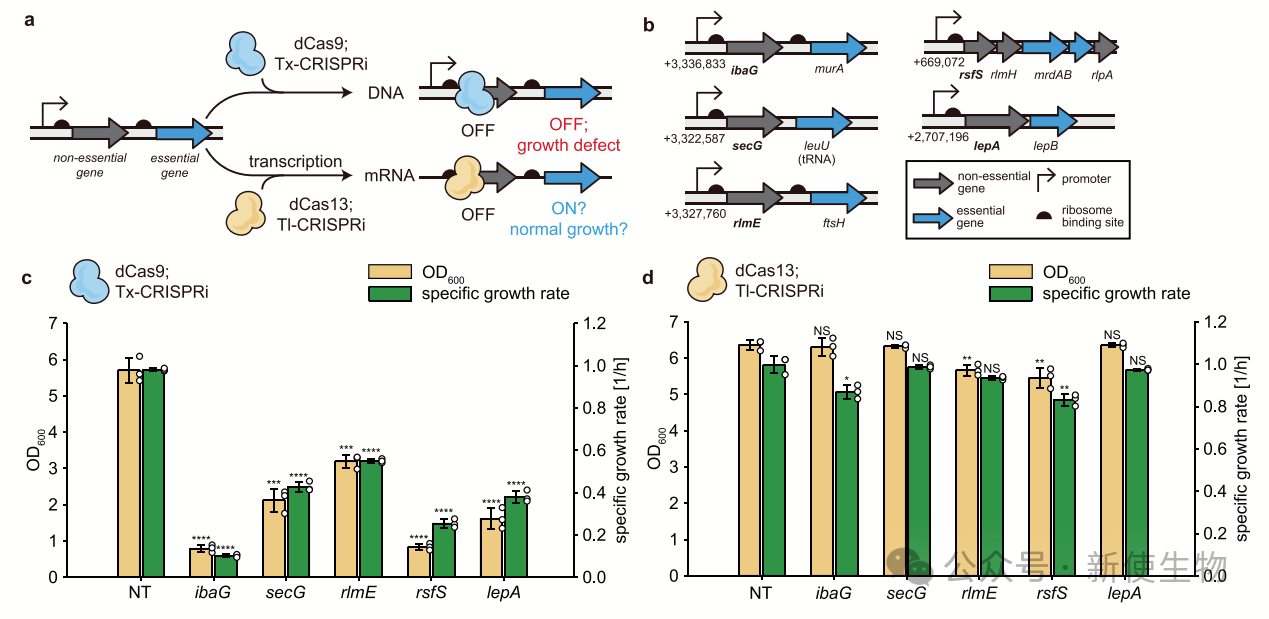
在多顺反子操纵子中,传统Tx-CRISPRi会关闭下游所有基因的表达,产生极性效应。
作者假设Tl-CRISPRi可以独立抑制每个基因而不影响邻近基因。实验表明,Tl-CRISPRi在靶向上游基因时不会显著影响下游基因表达,而Tx-CRISPRi会导致下游基因表达大幅降低。
在靶向非必需上游基因时,Tl-CRISPRi对细菌生长影响较小,而Tx-CRISPRi会导致生长迟缓。这表明Tl-CRISPRi能有效调控目标基因表达,减少极性效应。
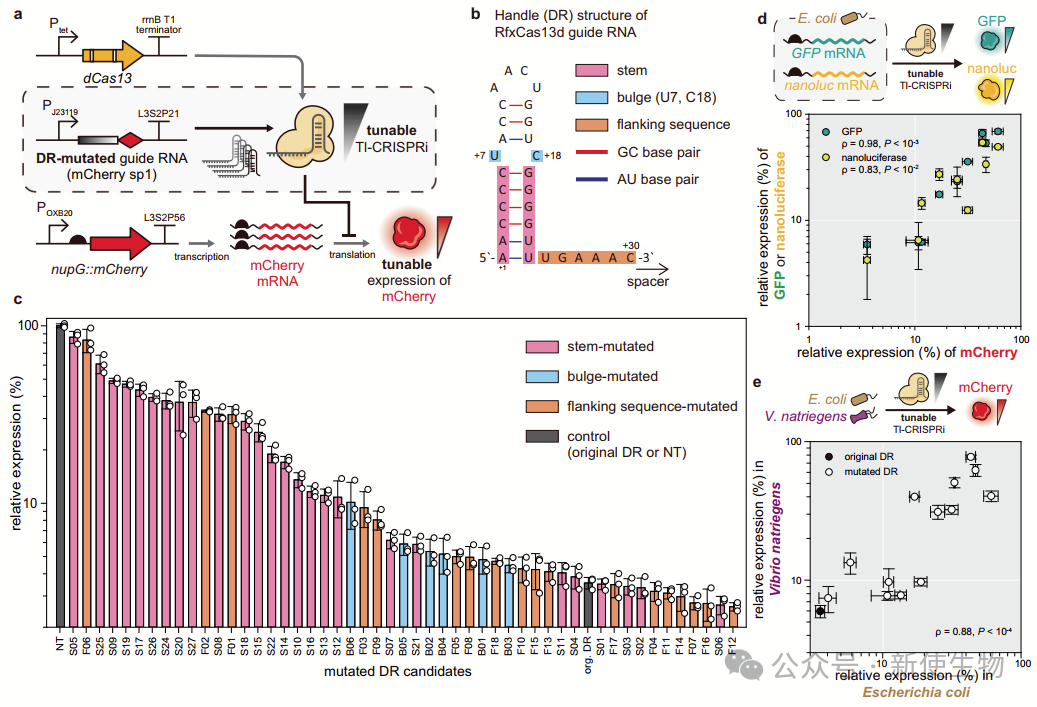
三. 通过Tl-CRISPRi工程化引导RNA柄序列实现可调节抑制
作者探索通过突变引导RNA的直接重复序列(DR)实现Tl-CRISPRi的可调节性。
系统突变引导RNA的干茎、膨胀区和侧翼序列,创建了不同DR序列的引导RNA,用于敲降mCherry,基因表达水平在2.6%到86.3%之间,并且突变的DR在其他基因中也有效。
研究团队还在需钠弧菌中验证了该系统的有效性,展示了其在不同微生物系统中精确调节基因表达的潜力。
四. 应用Tl-CRISPRi优化代谢通量
作者利用Tl-CRISPRi技术调节内源基因表达,优化代谢通量以增强有价值化合物的生产。
他们选定将丙二酰辅酶A转化为3-羟丙酸的途径,通过敲除关键基因如fabI显著提高了3-羟丙酸的产量,最高达到1.87 g/L,是未敲除菌株的11.1倍。
采用组合基因敲除策略,如同时敲除aceE和fabZ,进一步提升了产量。
尽管完全抑制脂肪酸合成有助于增产,但也显著抑制了微生物的生长。因此,作者尝试采用调节剂量的引导RNA来实现对fabI基因的适度抑制,以在大规模和高浓度碳源条件下保持高产。

总结
CRISPR-dCas13用于调控基因翻译水平表达,但精确控制仍有挑战。本文开发了Tl-CRISPRi系统,通过工程化指导RNA实现精准和可预测的mRNA翻译抑制。优化后的Tl-CRISPRi系统能特异和多重抑制基因翻译,尤其适用于独立调控多基因共价链中的各基因。调整指导RNA结构后,成功在大肠杆菌和嗜盐弧菌中实现多基因的可调抑制。该系统展示了在RNA靶向技术微生物工厂中优化通量的潜力。
新使生物(neoribo)推出国内首款超高分辨率翻译组ribo-seq建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
如有需有核糖体分析请联系杭州新使生物

关注新使生物,了解更多核糖体分析 前沿信息


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们