导读
蛋白质赖氨酸Nε-甲基化在生物过程中非常重要,尽管其对转录调控的影响已被广泛研究,但其在翻译中的作用仍未深入探索。
一些哺乳动物核糖体蛋白,如RPL4、RPL29、RPL40和RPL36A,它们被发现含有赖氨酸甲基化,特别是RPL40:
A)它是由UBA52基因编码的,去除泛素后的成熟形式为52个氨基酸,位于80S核糖体的关键区域,参与延长因子的结合和蛋白质合成。
B)在成熟的80S核糖体中,RPL40位于P柄/GTP酶激活中心(GAC)和Sarcin-Ricin环(SRL)附近,是延长因子eEF1A和eEF2的结合位点。
C)RPL40被认为选择性地调控与压力相关的mRNA翻译,并在酵母中赋予对延长抑制剂Sordarin的抗性,表明RPL40在蛋白质合成中具有重要功能。
重要的是,27年前,研究者通过质谱分析在大鼠肝脏中鉴定出了RPL40的K22三甲基化(RPL40 K22me3),并在最近核糖体结构研究中得以可视化验证。然而,这种修饰在翻译和核糖体功能中的作用仍然不清楚。
包含SET和MYND结构域的(SMYD)蛋白质是一类赖氨酸甲基转移酶,其中SMYD5被发现催化病毒Tat蛋白的甲基化,并与肝细胞癌(HCC)相关。研究表明,肝细胞癌中SMYD5 mRNA和蛋白水平升高,且与不良临床结果相关。
2024年8月5日,复旦大学蓝斐、蔡加彬团队在Cell Research上发表了一篇题为“SMYD5 is a ribosomal methyltransferase that catalyzes RPL40 lysine methylation to enhance translation output and promote hepatocellular carcinoma”的论文,发现SMYD5主要催化RPL40的K22三甲基化,这对高效的翻译延长和蛋白质合成至关重要,揭示了SMYD5介导的RPL40 K22me3在癌症生长中的关键作用,表明SMYD5-RPL40 K22me3轴可能成为肝细胞癌治疗的新策略。

文章索引
【标题】SMYD5 is a ribosomal methyltransferase that catalyzes RPL40 lysine methylation to enhance translation output and promote hepatocellular carcinoma
【发表期刊】Cell Research
【发表日期】2024年8月5日
【作者及团队】复旦大学蓝斐、蔡加彬团队
【IF】28.1
研究结果
一. SMYD5在体外对核糖体蛋白RPL40进行三甲基化
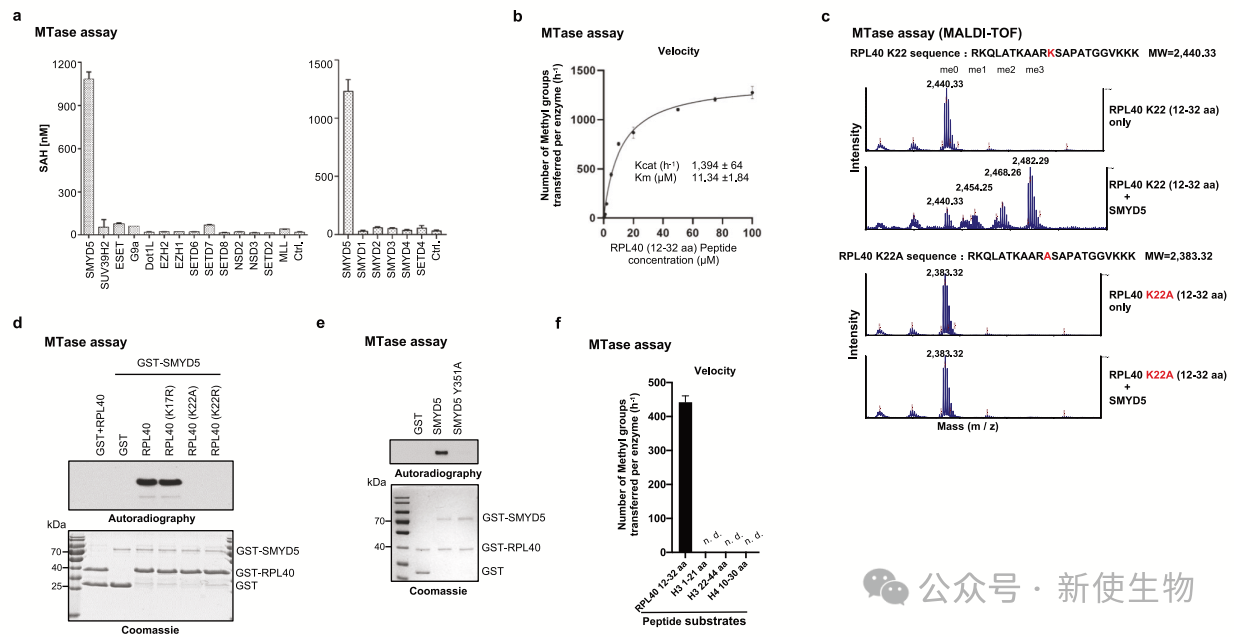
作者筛选了一组SET结构域的赖氨酸甲基转移酶,发现只有SMYD5能在体外甲基化RPL40。
进一步实验确认SMYD5在RPL40的K22位点进行三甲基化,且对K22位点的特异性很高,催化失活的SMYD5突变体不能甲基化RPL40。SMYD5对组蛋白没有活性,但对RPL40表现出强的甲基转移酶活性。
二. RPL40是SMYD5在人体细胞中的主要胞质底物
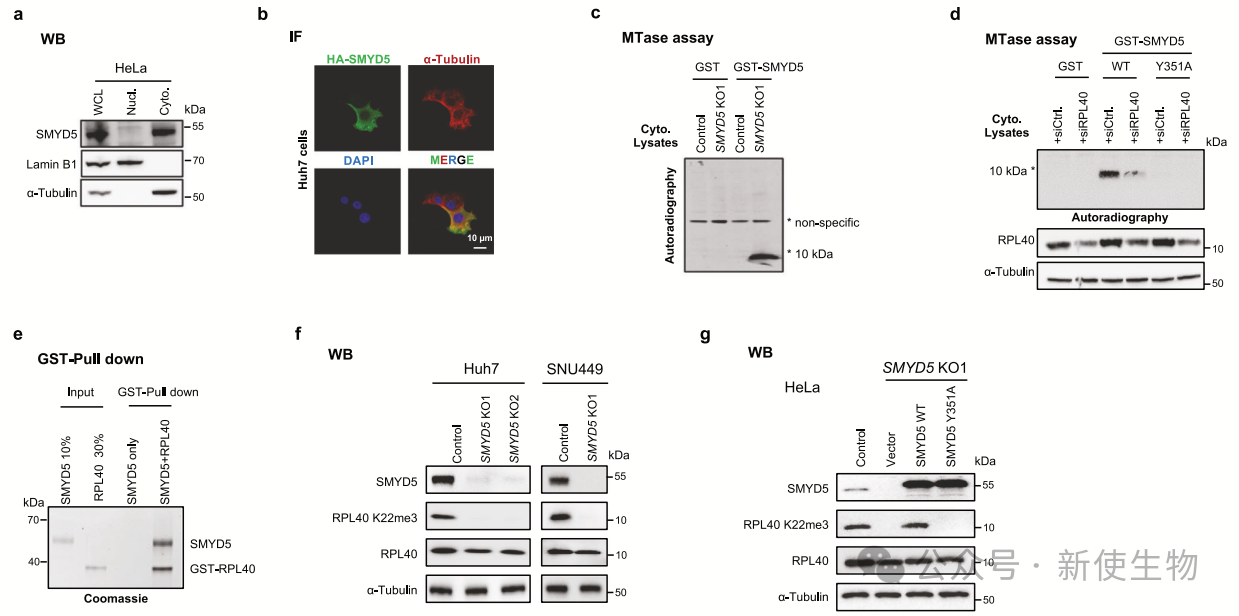
作者发现SMYD5主要定位于HeLa和Huh7细胞的胞质中,并缺乏对组蛋白的活性。实验显示,RPL40是SMYD5的主要胞质底物。
通过质谱分析和体外甲基化测定确认,SMYD5在RPL40的K22位点进行三甲基化。
免疫共沉淀实验进一步验证了SMYD5与RPL40的直接相互作用。SMYD5敲除细胞中RPL40 K22me3信号消失,表明SMYD5是生成RPL40 K22me3的关键酶。
三.SMYD5和RPL40 K22me3影响多聚核糖体分布,并促进全局翻译输出
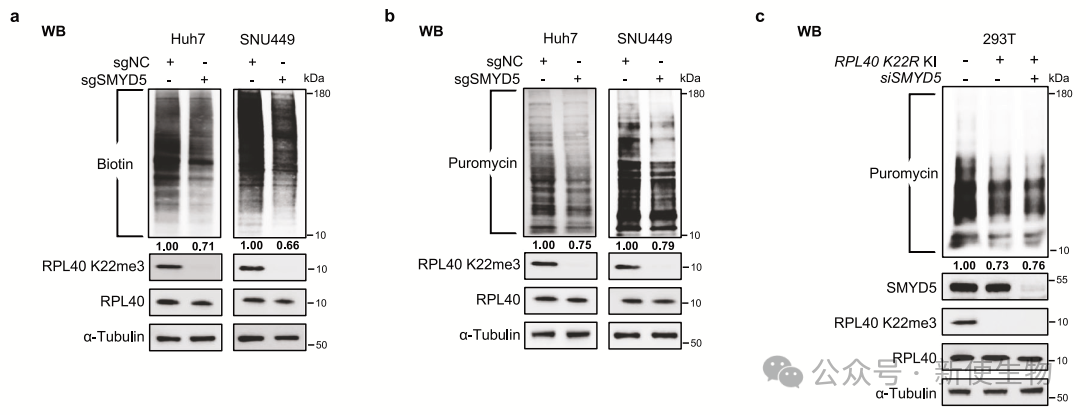
SMYD5和RPL40 K22me3影响核糖体功能和翻译。SMYD5敲除细胞中,40S、60S和80S部分基本不受影响,但多聚核糖体减少,并出现半子体形成,表明活性核糖体动态变化。
SMYD5缺失导致全局翻译输出减少20%-30%,这一效应与RPL40的K22位点有关。
四. SMYD5增强了mRNA翻译效率(TE)
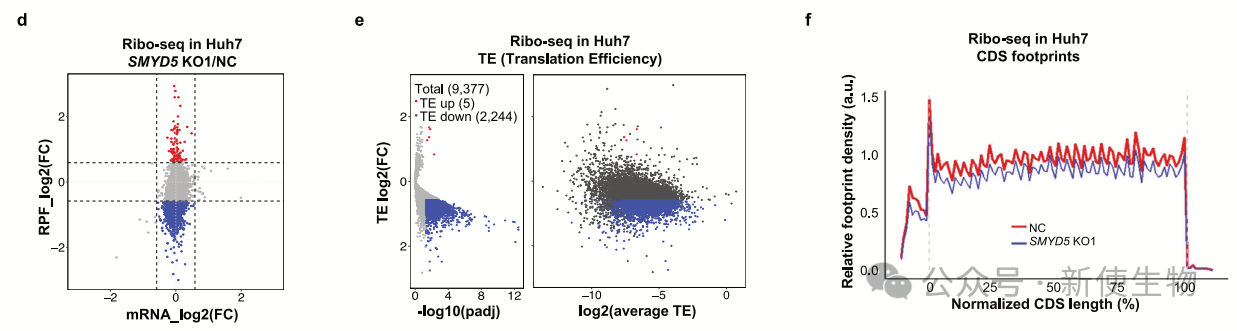
作者在Huh7对照细胞和SMYD5 KO细胞中进行Ribo-seq(核糖体印迹分析)发现,SMYD5缺失显著降低了核糖体保护的足迹(RPFs),表明全局翻译减少,而转录组几乎未受影响。
翻译效率(TE)在大多数mRNA中显著降低,尤其是初始TE水平较高的mRNA。SMYD5 KO细胞中的核糖体结合全局减少,但翻译减少是均匀的。这表明SMYD5-RPL40 K22me3轴对维持全局翻译输出至关重要。
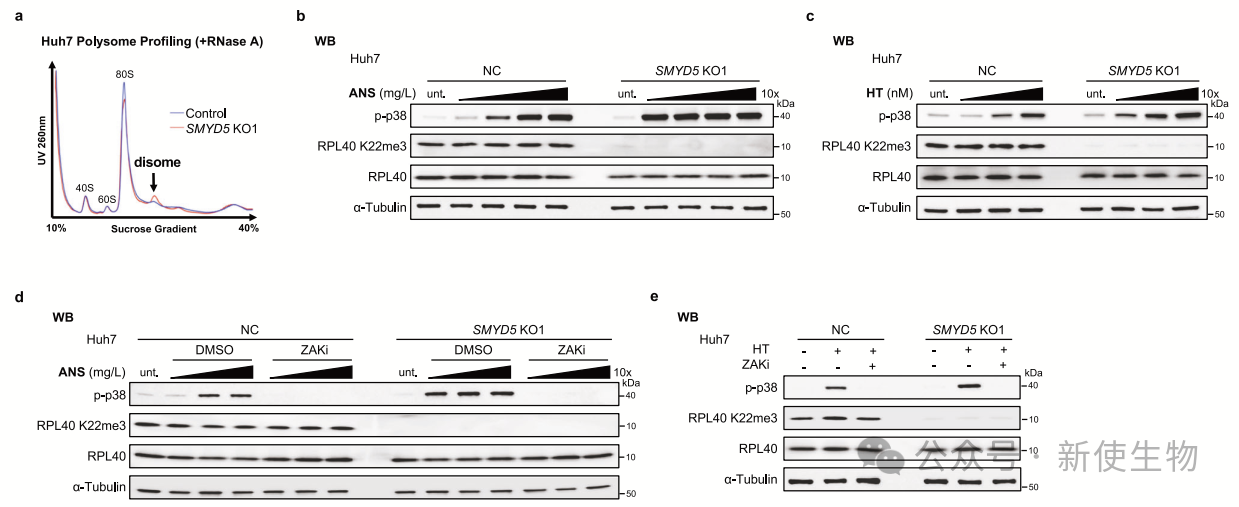
五. SMYD5-RPL40 K22me3轴的丧失导致延长阶段的扰动,并对靶向A位点的翻译抑制剂表现出高敏感性
SMYD5和RPL40 K22me3的丧失导致延长阶段的扰动和核糖体停滞,作者利用Polysome profiling(多聚核糖体分析)发现了增加的双核糖体的形成。
MYD5缺失的细胞对靶向A位点的翻译抑制剂(如ANS和HT)的敏感性显著增加,但对其他抑制剂(如CHX、UVB和Menadione)无显著变化。这表明SMYD5-RPL40 K22me3在维持核糖体功能和应对延长扰动中起关键作用。
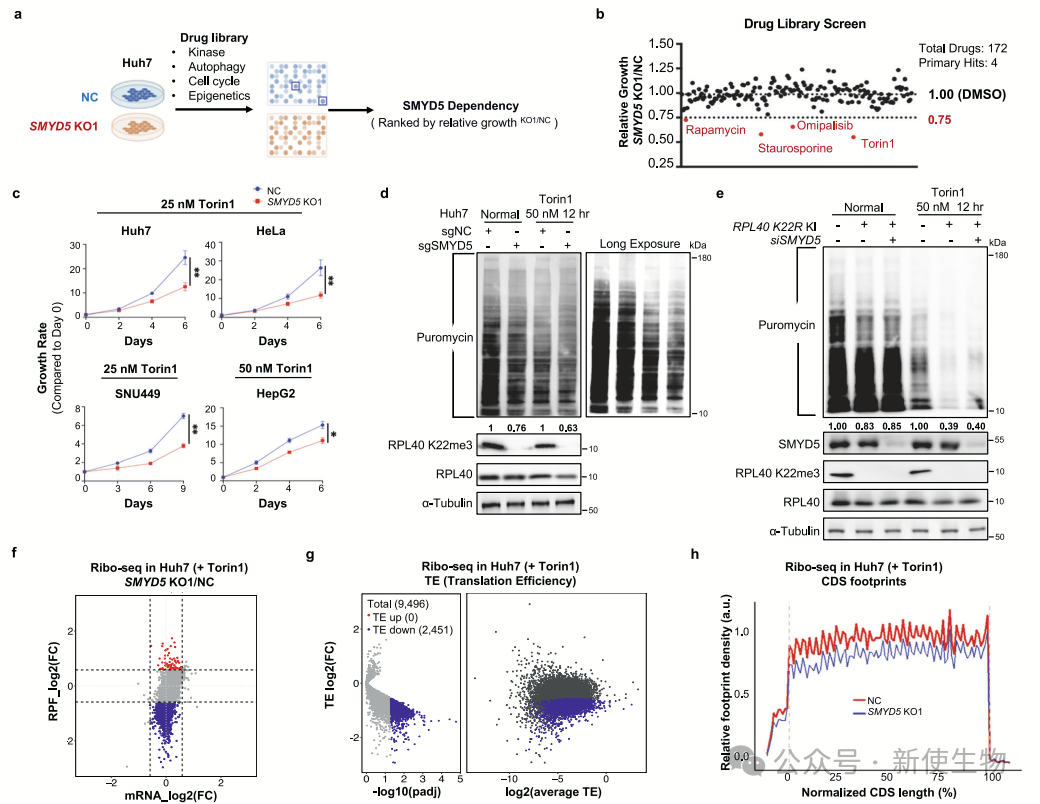
六. SMYD5的丧失使癌细胞对mTOR通路阻断更敏感
SMYD5缺失会增强肝细胞癌(HCC)细胞对mTOR抑制剂的敏感性。尽管SMYD5缺失不会影响正常细胞增殖,但在mTOR抑制下,会显著减少蛋白质合成并抑制细胞生长,尤其在Huh7和SNU449细胞系中。
基因集富集分析显示,SMYD5缺失下,mTOR抑制会影响核糖体生成和细胞增殖信号。
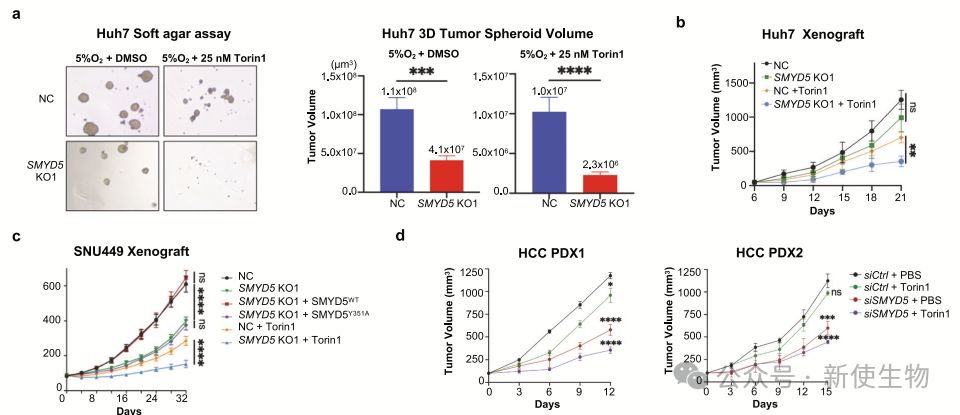
七. SMYD5的缺失与mTOR抑制剂的联合使用协同作用,能够有效抑制肝细胞癌的发展
SMYD5缺失与mTOR抑制剂联用显著抑制HCC肿瘤生长。体外实验和小鼠模型显示,SMYD5缺失细胞在mTOR抑制下生长受限。
临床分析表明,SMYD5和RPL40 K22me3高表达与HCC预后不良相关。在HCC异种移植模型中,SMYD5 siRNA联合mTOR抑制剂显著抑制肿瘤生长。这表明SMYD5和RPL40 K22me3在HCC进展中发挥关键作用。
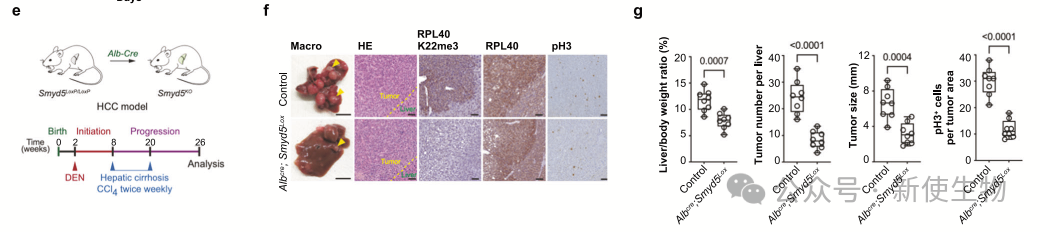
八. SMYD5促进肝细胞癌体内的发展
作者通过在肝细胞特异性Cre重组酶小鼠中敲除SMYD5,研究发现,SMYD5缺失显著减少了肝脏中的肿瘤负担和肿瘤结节数目,且肿瘤体积也显著降低。
SMYD5缺失还导致RPL40 K22me3标记完全丧失,并抑制了肿瘤细胞增殖。这些结果支持了SMYD5及其介导的RPL40 K22me3在HCC肿瘤发生中的关键作用。
总结
本文研究发现,SMYD5主要催化RPL40 K22的三甲基化 (K22me3),影响翻译效率。SMYD5和RPL40 K22me3在肝细胞癌中上调,并与预后负相关。SMYD5缺失使HCC细胞对mTOR抑制剂更敏感,并显著抑制了HCC的发展和生长。此研究揭示了SMYD5-RPL40 K22me3在翻译中的作用,并可作为HCC治疗的潜在靶点。
新使生物NeoRibo推出国内首款超高分辨率翻译组Ribo-seq建库试剂盒。
我们的Ribo-seq核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com

关注新使生物,了解更多核糖体分析前沿信息


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们