导读
假尿苷化是常见的RNA修饰之一,参与多种细胞过程,能够增强碱基稳定性、改善碱基配对并稳定糖磷酸骨架,从而调控基因表达。
该修饰的研究主要集中在tRNA、rRNA和snRNA中的假尿苷(Ψ)位点,其失调与肿瘤发生相关,虽然转录组技术揭示了Ψ在mRNA中的存在,但其生物功能仍不明确。
假尿苷化由假尿苷合成酶(PUS)催化,分为六个家族,其中PUS7为TruD家族唯一成员,参与癌症发展:
A)PUS7失活会影响胚胎干细胞中的tRNA调控,导致蛋白质合成增加和分化缺陷。
B)PUS7通过上调LASP1促进结直肠癌细胞转移,且在mRNA中也能进行Ψ修饰,功能尚待研究。
ALKBH3是去烷基化修复酶,能修复RNA和DNA中的烷基化损伤,促进癌细胞增殖和转移,但其在胃癌中的作用尚未报道。
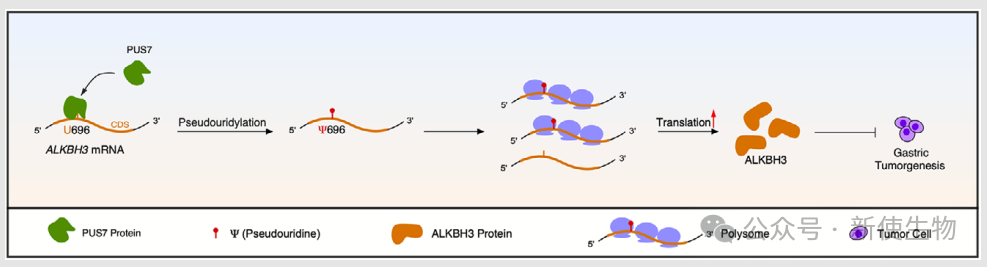
2024年8月23日,浙江大学医学院周天华和浙江大学医学院附属儿童医院谢珊珊团队在Clinical and Translational Medicine上发表了一篇题为“PUS7-dependent pseudouridylation of ALKBH3 mRNA inhibits gastric cancer progression”的论文,发现PUS7通过催化活性作为新的胃肿瘤抑制基因,其通过Ψ修饰ALKBH3 mRNA提高其翻译效率,从而抑制胃肿瘤生长。

文章索引
【发表日期】2024年8月23日
【IF】9.9
研究结果
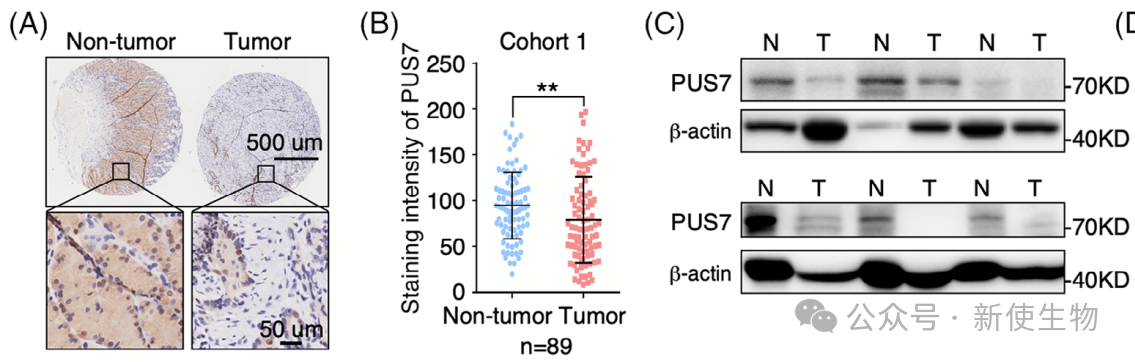
一. PUS7在胃肿瘤组织中显著下调
作者研究了PUS7在胃癌中的作用,发现其在两个独立队列中的胃肿瘤组织中表达显著降低。
免疫组化和免疫印迹均证实,胃肿瘤组织的PUS7蛋白水平低于相应的非肿瘤组织,这表明PUS7可能在胃癌发生中起重要作用。
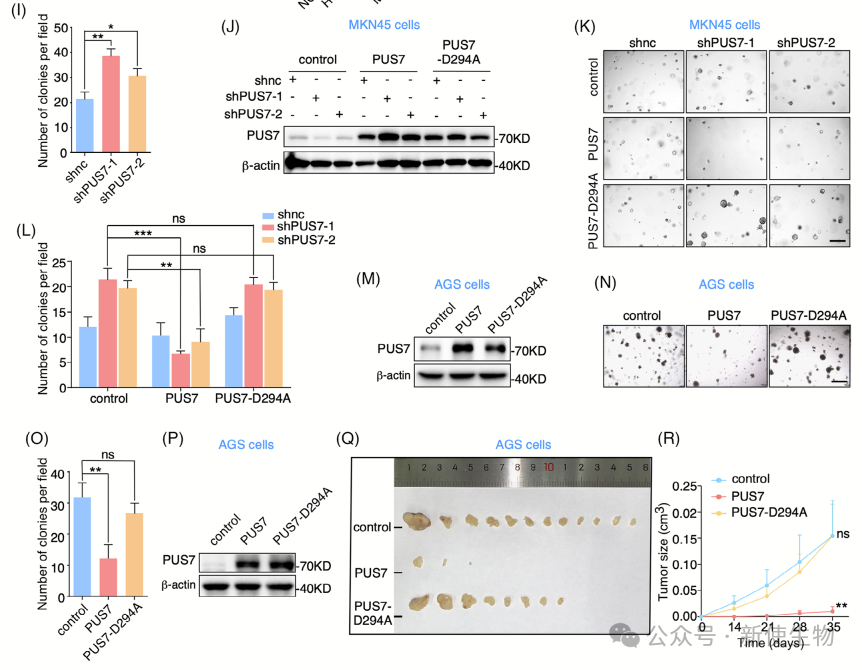
二. PUS7通过其Ψ合成酶活性抑制胃癌细胞增殖
作者发现PUS7在MKN45胃癌细胞中高表达,而在AGS细胞中低表达。敲低PUS7显著增强了MKN45细胞的增殖、迁移和侵袭,而异位表达PUS7则抑制了这些能力。
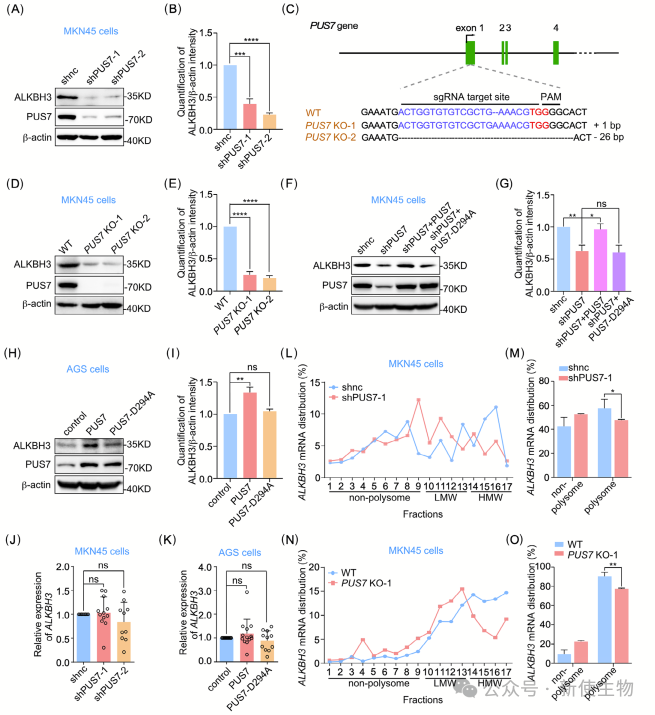
三. PUS7增加ALKBH3水平及其mRNA翻译
作者发现敲低PUS7显著降低了MKN45细胞中去甲基酶ALKBH3的表达。
Polysome profiling多聚核糖体分析显示,PUS7缺失对ALKBH3 mRNA水平影响不大,但抑制了其翻译效率,并且PUS7缺失的细胞中ALKBH3 mRNA主要位于单聚体组分中,表明PUS7通过促进ALKBH3的翻译效率来增加其蛋白水平。
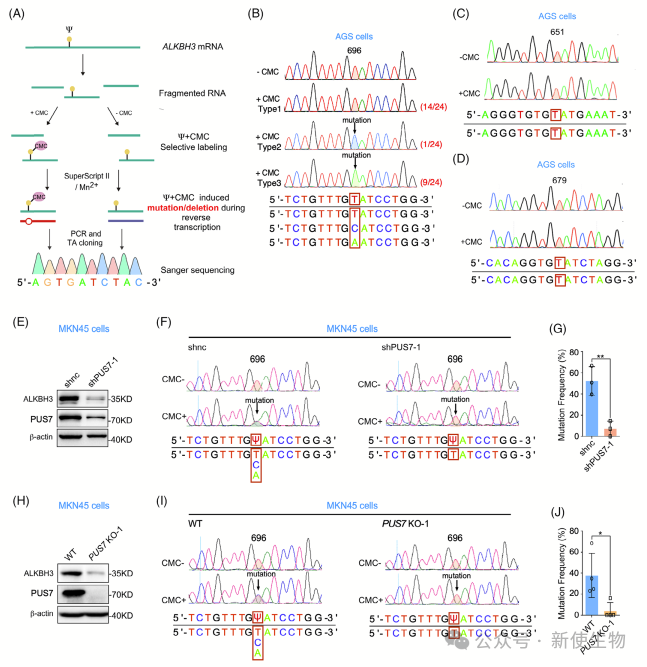
四. PUS7通过在U696位点对ALKBH3 mRNA进行Ψ修饰来装饰其结构
作者识别了ALKBH3 mRNA中的三个潜在Ψ位点(U651、U679和U696)。CMC标记和RT-qPCR分析显示,ALKBH3 cDNA在Ψ位点的读取比率显著降低,表明存在Ψ修饰。
此外,PUS7缺失或敲除显著降低696位点的突变频率,表明PUS7在ALKBH3 mRNA的U696位点上催化Ψ修饰。
五. PUS7通过ALKBH3抑制胃肿瘤生长
作者发现在小鼠模型中,ALKBH3的缺失显著增强了MKN45细胞的增殖、迁移和侵袭能力,而过表达ALKBH3则逆转了这种现象。
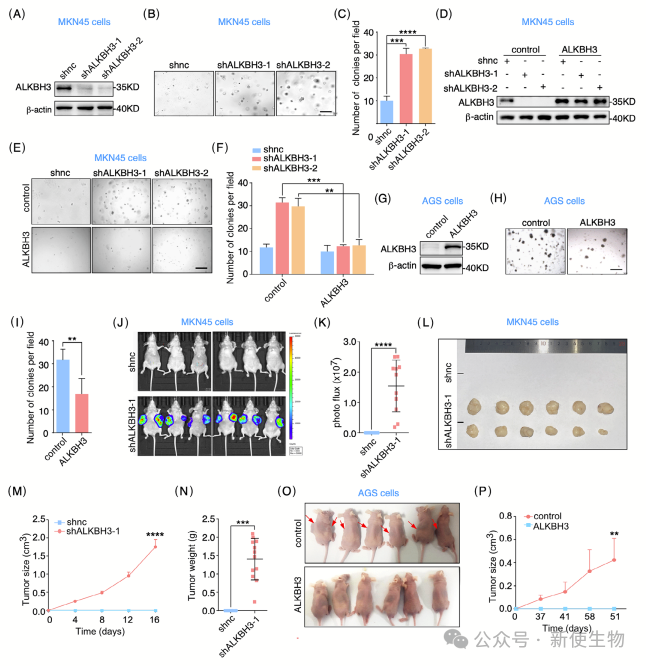
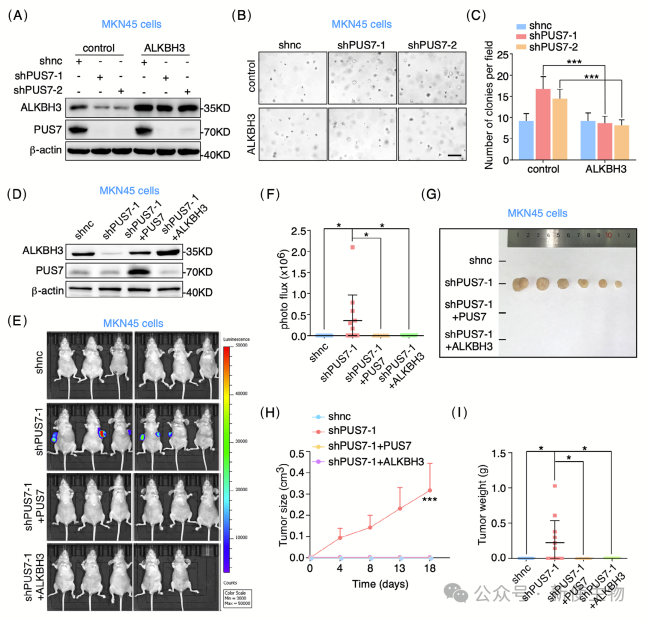
此外,实验表明ALKBH3介导了PUS7在胃肿瘤发生中的功能,PUS7的缺失被ALKBH3的过表达显著逆转。
总体而言,这些结果表明PUS7通过ALKBH3抑制胃肿瘤生长。
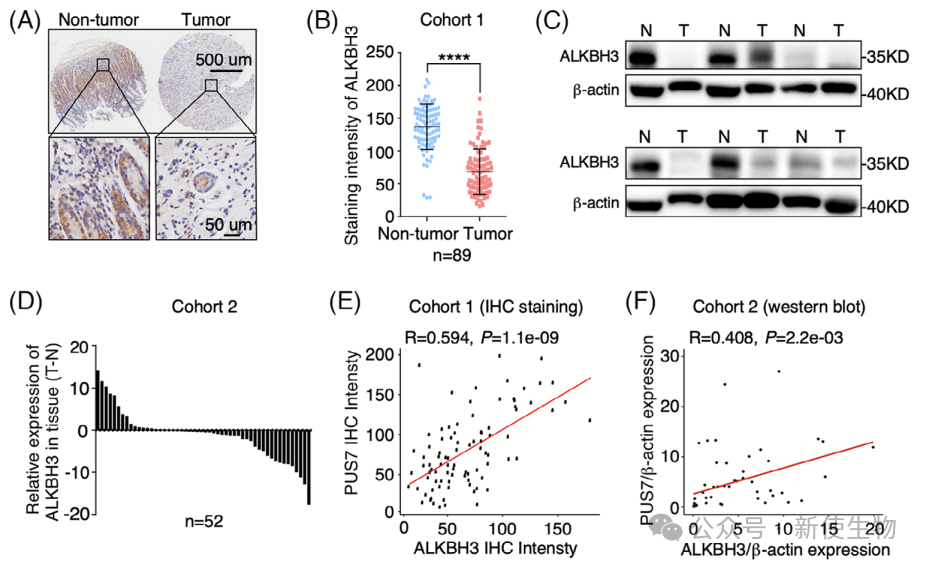
六. PUS7和ALKBH3的表达在胃癌组织中显著相关
作者检查了人类胃肿瘤组织及其配对非肿瘤组织中ALKBH3的表达。
组织微阵列的免疫组化分析和蛋白印迹均显示,胃肿瘤组织中的ALKBH3表达显著降低,这些分析结果表明PUS7与ALKBH3在胃肿瘤组织中的水平显著相关。
总结
本研究发现,胃癌组织中PUS7显著减少,且其通过催化活性抑制胃癌细胞增殖和肿瘤生长。PUS7还通过在U696位点进行假尿苷修饰,增强ALKBH3 mRNA的翻译效率,进而减缓肿瘤生长,提示其可能成为胃癌的新治疗靶点。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 杭州新使生物有限公司

感谢关注新使生物,翻译组测序可咨询联系


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们