导读
肿瘤常因基因突变、缺氧以及恶劣的肿瘤微环境(TME)中的营养缺乏而面临能量匮乏,同时抗癌治疗也会加剧这种状况。这种代谢压力会触发mRNA翻译的适应性重编程,从而调整代谢可塑性及相关的信号通路,以维持肿瘤细胞的生存。
新兴证据逐渐揭示了代谢与mRNA翻译之间复杂的相互作用,阐明了在代谢压力下同步核糖体组装和重塑翻译程序的机制。
2024年11月27日,法国国家健康与医学研究院Michael Cerezo团队在Trends in Cell Biology上发表了一篇名为“Metabolism and mRNA translation: a nexus of cancer plasticity”的综述,探讨了代谢与mRNA翻译协同调控方面的最新进展,为靶向癌症代谢与翻译的治疗策略提供了新的见解。

文章索引
【标题】Metabolism and mRNA translation: a nexus of cancer plasticity
【发表期刊】Trends in Cell Biology
【发表日期】2024年11月27日
【作者及团队】法国国家健康与医学研究院Michael Cerezo团队
【IF】20.808
综述整理
一. 代谢与翻译:肿瘤可塑性的“探戈”
肿瘤生长依赖蛋白质合成,需大量能量和核糖体活性。代谢信号通过调控mRNA翻译,平衡资源分配与营养供给,维持细胞增殖与存活。
癌细胞通过翻译重编程和代谢适应来应对营养匮乏的肿瘤微环境(TME),通过代谢重塑动态调控糖酵解与线粒体呼吸,并精细调节mRNA翻译以适应代谢压力和资源匮乏。
mRNA翻译在治疗抗性中发挥关键作用,其与代谢的协同作用赋予肿瘤细胞快速调整蛋白质组和代谢的能力,推动肿瘤可塑性。
二. 癌细胞代谢精细调控mRNA翻译
代谢信号通过整合应激反应(ISR)调控mRNA翻译,帮助细胞适应营养变化。ISR激酶通过磷酸化eIF2α抑制蛋白质合成,但优先翻译含uORFs的mRNAs(如ATF4),激活适应性通路应对营养匮乏。【ATF4在治疗抗性和代谢适应中关键,抑制其活性可增强抗肿瘤治疗效果】
代谢变化影响翻译延伸过程,eEF2K在营养缺乏时通过AMPK激活降低翻译延伸,但肿瘤细胞的eEF2K调控减弱,促进适应性翻译。
此外,营养信号调控tRNA和mRNA修饰,如U34的硫化修饰和t6A修饰,支持肿瘤生长和治疗抗性。
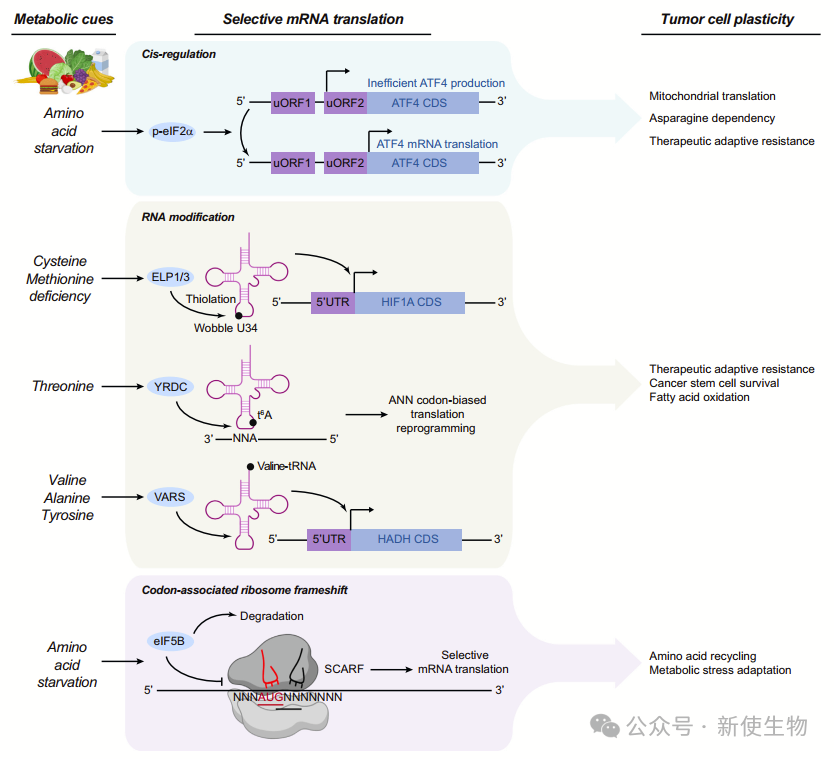
三. 翻译对代谢酶的影响
代谢信号精细地调控翻译,进而通过翻译起始因子、RNA结合蛋白(RBP)和局部翻译等机制来调节代谢程序。
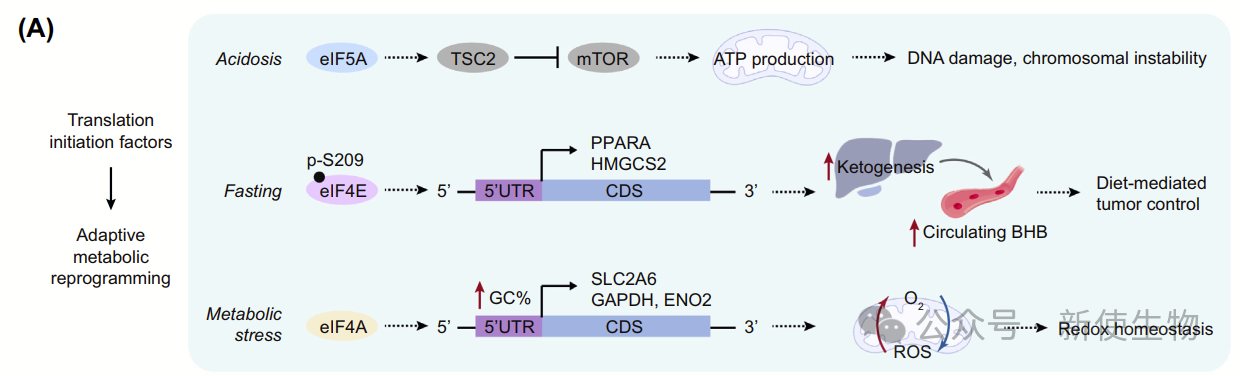
3.1)翻译因子在代谢程序调控中的作用
肿瘤细胞通过厌氧代谢适应缺氧,导致酸中毒并可能引起DNA损伤。eIF5A翻译起始因子在此过程中通过重塑翻译引发代谢抑制,保护基因组。
eIF5A通过结合TSC2 mRNA,增加TSC2蛋白水平,抑制mTORC1,推动代谢抑制,避免DNA损伤。不仅如此,抑制eIF5A还可提高神经胶质瘤细胞的ATP消耗,增强其对化疗药物的敏感性。
多个翻译起始因子在肿瘤代谢调控中发挥作用,如磷酸化的eIF4E通过重塑肝脏翻译调控酮体生成,响应饮食变化。禁食诱导的eIF4E磷酸化增强关键代谢酶(如PPARA和HMGCS2)的翻译,促进β-氧化和酮体生成,因此抑制eIF4E磷酸化或表达非磷酸化突变体可降低这些酶的翻译,并减少血液中的β-羟基丁酸。
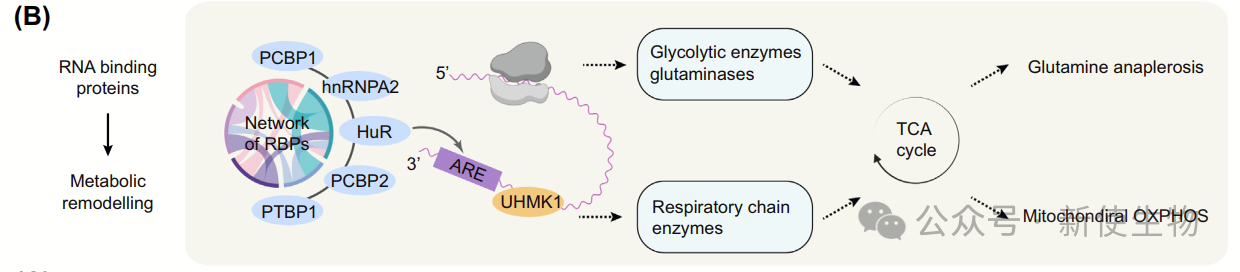
3.2)RNA结合蛋白调控代谢
RNA结合蛋白(RBPs)通过调控特定mRNA的翻译,在肿瘤细胞的代谢适应中发挥重要作用。
A)缺氧时,RBPs(如HuR)通过结合糖酵解相关mRNA,增强其翻译,促进厌氧糖酵解。
B)在乳腺癌中,HuR调控谷氨酰胺稳态,推动肿瘤细胞对谷氨酰胺的依赖。
C)此外,UHMK1通过选择性翻译线粒体蛋白mRNA,帮助肿瘤细胞适应BRAF抑制剂治疗中的代谢变化。
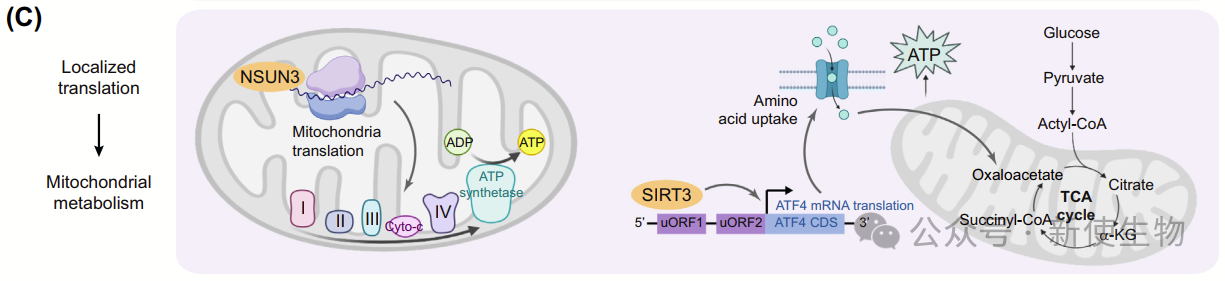
3.3)局部翻译在代谢调控中的作用
近年来,线粒体呼吸在某些癌细胞中的重要性被认可,线粒体内13个氧化磷酸化亚单位通过局部翻译合成,这一过程依赖特定的线粒体机制。其中tRNA-甲硫氨酸(tRNAMet)包含5-甲酰胞嘧啶(f5C),能够识别AUA和AUG起始密码子,从而调节翻译效率。
线粒体RNA修饰调控翻译,影响代谢重编程,比如去除线粒体RNA甲基转移酶NSUN3会导致关键呼吸链蛋白的合成减少,使代谢从OXPHOS转向糖酵解。
在弥漫大B细胞淋巴瘤中,线粒体Sirtuin蛋白SIRT3介导的ATF4局部细胞质翻译优化了氨基酸的摄取和利用。
四. 信号通路连接代谢与mRNA翻译
细胞代谢和mRNA翻译通过关键的信号通路紧密协调,使蛋白质合成与代谢状态相匹配。
在癌症中,这些通路将营养可用性与翻译效率同步,促进肿瘤的可塑性和治疗耐药性。
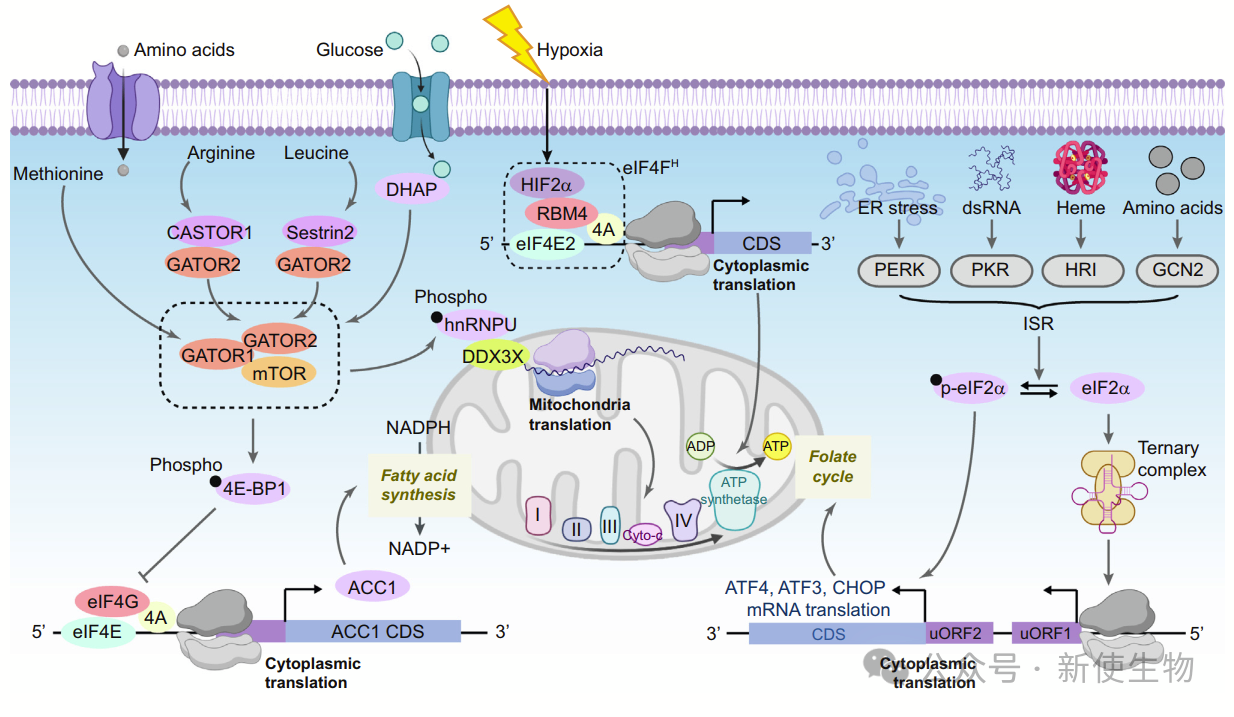
4.1)mTOR:氨基酸稳态和翻译的关键枢纽
mTORC1通路是代谢与翻译之间的关键枢纽,感知氨基酸如甲硫氨酸、亮氨酸和精氨酸,并调节翻译。
A)甲硫氨酸通过S-腺苷甲硫氨酸(SAM)被感知,甲硫氨酸缺乏时形成SAMTOR-GATOR1复合物,抑制mTORC1。
B)亮氨酸通过Sestrins感知,Sestrin-2在亮氨酸缺乏时与GATOR2结合,抑制mTORC1。
C)精氨酸通过CASTOR1感知,在精氨酸缺乏时结合GATOR2,抑制mTORC1和依赖帽的翻译。
研究发现糖类也能激活mTORC1,影响翻译和细胞增殖。mTORC1通过磷酸化eIF4E结合蛋白调节翻译起始,抑制ACC1翻译,维持NADPH稳态。
4.2)缺氧途径调控代谢与翻译
细胞在缺氧条件下通过转变翻译机制支持生存。缺氧时,ATP供应不足导致经典蛋白合成减慢,需要替代机制。
缺氧肿瘤细胞的存活部分依赖于HIFs的活性,HIF2α在缺氧压力下调控帽依赖性翻译起始。
此外,人类乳腺癌基因mRNA的5′-UTR含内部核糖体结合位点(IRES),能独立于eIF4F复合物直接结合核糖体。
4.3)代谢整合应激反应与mRNA翻译的综合调控
整合应激反应(ISR)通过eIF2α磷酸化调控翻译和代谢,抑制全局蛋白合成并选择性翻译特定转录因子(如ATF4、ATF3、CHOP),促进氨基酸和一碳代谢。
GCN2作为响应代谢应激的重要激酶,通过磷酸化eIF2α选择性翻译ATF4,支持癌细胞的适应性变化。
AMPK作为能量传感器,调节癌细胞能量需求,通过调控MNK激酶及其底物P-eIF4E,在禁食和生酮饮食期间促进特定mRNA的翻译。
五. 靶向代谢与翻译的治疗进展
维持代谢程序和mRNA翻译之间的微妙平衡对于肿瘤细胞的可塑性和存活至关重要,因此靶向改变的代谢通路或翻译机制的药物为一种有前景的治疗策略。
5.1)抑制mTORC1通路:癌症可塑性的重要催化剂与重塑者
多种疗法通过抑制mTORC1通路来抑制癌症进展,并与其他靶向治疗结合有望提高效果。
A)激酶抑制剂和双胍类药物可协同抑制mTORC1,但翻译重编程可能通过替代途径合成氨基酸,削弱疗效,将mTORC1抑制剂与特定氨基酸禁食结合或许更有效。
B)mTORC1抑制剂和化疗药物增强特定mRNA亚型翻译,维持乳腺癌细胞的干细胞样状态,整合应激反应抑制剂可克服耐药性。
C)对于增殖癌细胞,mTORC1抑制剂通过抑制SLC4A7翻译减缓核苷酸合成,靶向SLC4A7可增强肿瘤对mTORC1抑制的敏感性。
5.2)靶向核糖体生物合成以增强代谢
核糖体生物合成抑制剂,如RNA聚合酶I(Pol I)抑制剂,选择性地降低癌细胞中与能量代谢相关的mRNA的翻译效率。在针对Pol I抑制剂CX-5461的首个人体试验中,其在血液恶性肿瘤中表现出疗效。
MYC癌基因在肿瘤细胞的代谢和翻译中起着重要作用。MYC过表达增加细胞内的三磷酸腺苷(GTP)水平,促进核糖体生物合成。
5.3)靶向翻译相关因子以改变代谢和mRNA翻译
在能量缺乏条件下,翻译起始是癌症治疗的关键。AMPK激动剂AICAR能迅速抑制肝细胞癌的蛋白合成,癌症的可塑性部分依赖于在这种条件下对应激反应mRNA的翻译增加,这使得翻译起始机制成为有吸引力的治疗靶点。
此外,eIF4G相关的翻译起始已被研究多年,4EGI-1通过抑制eIF4E与eIF4G1的相互作用来阻断帽依赖性翻译。eIF4A也在胰腺癌的代谢中起重要作用,联合抑制eIF4A和谷氨酸酶可抑制肿瘤生长。
此外,局部翻译在代谢应激下调节癌细胞可塑性方面起着关键作用。线粒体翻译抑制被广泛研究用于靶向肿瘤特异性的代谢和翻译重塑。【例如,抗生素tedizolid通过抑制线粒体翻译增强AML治疗效果。Q/D抗生素可防止胶质母细胞瘤干细胞状态转变。】
此外,微环境变化可引发翻译重编程,eIF2α抑制剂联合治疗可能克服肿瘤治疗中的耐药性。
总结
mRNA翻译和代谢重编程是癌细胞维持高增殖性和逃避治疗的关键机制。代谢和翻译调控的复杂性源于肿瘤异质性,且这些过程是动态变化的。当前研究技术在单细胞水平的灵敏度和可扩展性有限,但未来如单细胞Ribo-seq等创新技术有望揭示翻译调控的新机理。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登联系杭州新使生物有限公司

感谢关注杭州新使生物,polysome profiling可咨询联系


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们