导读
数十万个小于100个密码子的小开放阅读框(smORFs)广泛存在于每个基因组中,尤其是在长非编码RNA(lncRNA)和mRNA的5′非翻译区中。
尽管smORFs通常被认为是无功能的,但Ribo-seq(核糖体印迹分析)表明,有数千个smORFs会被翻译。
已被研究的smORF功能从个例逐渐展现出可识别的规律:smORFs可以具有顺式非编码调控功能(涉及低水平翻译的无功能肽)或完全的编码功能(由强翻译的多肽介导),这些多肽通常作为膜相关的调节因子,发挥细胞和生理作用,并调控经典蛋白质。进化背景表明,许多smORFs是非编码序列新生的基因。
2024年11月26日,西班牙安达卢斯中心Juan Pablo Couso团队在Trends in Genetics上发表了一篇题为“Cis to trans: small ORF functions emerging through evolution”的综述,认为顺式非编码smORF功能为后续进化出完整肽功能提供了生态位。

文章索引
【标题】Cis to trans: small ORF functions emerging through evolution
【发表期刊】Trends in Genetics
【发表日期】2024年11月26日
【作者及团队】西班牙安达卢斯中心Juan Pablo Couso团队
【IF】13.6
综述整理
一. 短编码序列的世界
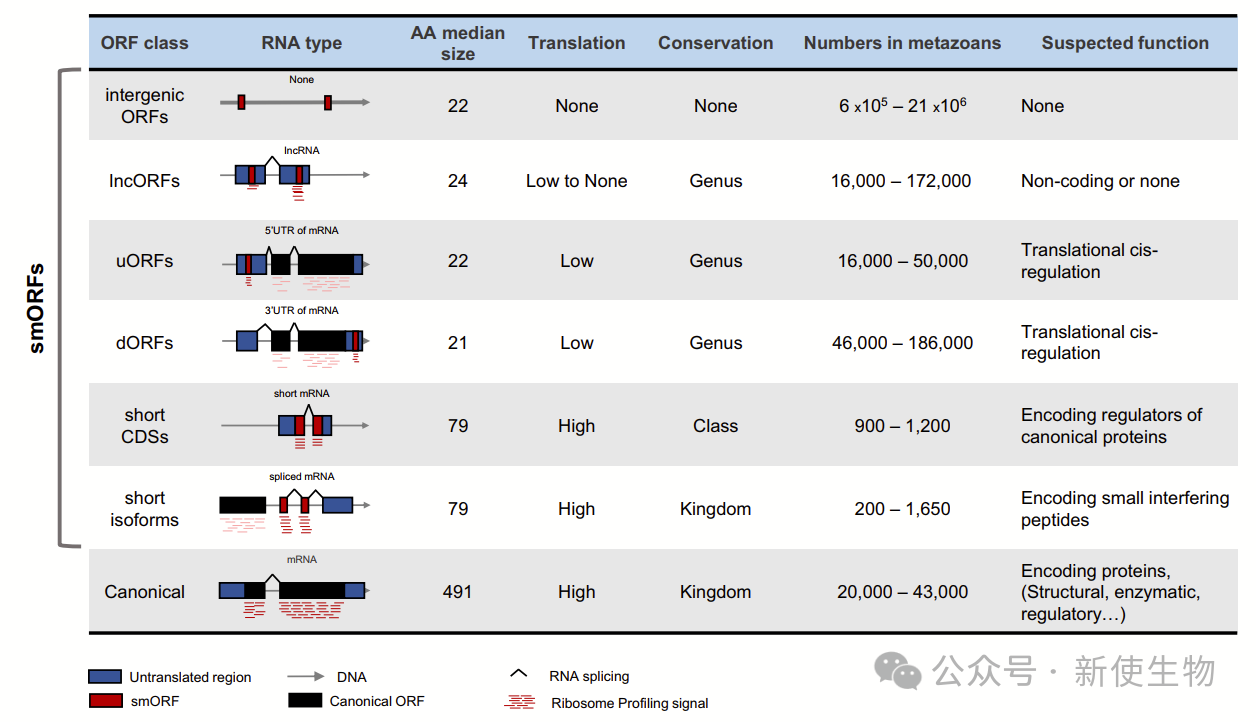
1.1)小开放阅读框(smORFs)介绍
smORFs是能翻译成小肽或短蛋白(小于100个氨基酸)的DNA或RNA序列,起始于ATG/AUG(或非经典起始密码子)并以终止密码子结束。真核生物基因组中smORFs数量从果蝇的数十万到人类的数百万不等,其中许多映射到潜在的非编码RNA上。
过去,smORFs因数量多、规模小及功能研究不足而被视为非编码,未被注释。如今,越来越多证据表明,数百至数千个smORFs可被翻译,其短肽可能具有重要功能并在进化中高度保守,揭示了基因组中可能存在一个“隐藏的基因组”。
1.2)smORFs 的分类与功能
smORFs平均约25个密码子,大小和数量分布符合随机起源。根据基因组特征,smORFs分为从无功能基因间ORFs到调控经典蛋白的功能性序列。
数万个(10%)出现在RNA转录本中,包括mRNA的uORFs、dORFs和lncORFs,常呈多顺反子排列。约1000个(1%)翻译为80个氨基酸左右的短肽或短蛋白(sCDSs),通常是短mRNA中唯一的编码ORF。
1.3)smORFs 的研究进展与挑战
smORF功能研究因其短小的特性难以检测或通过同源性识别。早期在酵母中首次提出“smORF问题”,注释时人为设定100个氨基酸长度限制(细菌为50个),导致smORFs长期局限于原核研究。
在果蝇中,研究发现了由tarsal-less (tal)基因编码的11个氨基酸的多肽,尽管该基因最初被标注为lncRNA,但实际上具有编码功能,对发育至关重要,并且在节肢动物中保守。
类似的研究还发现了调控肌浆网钙泵的sarcolamban smORF家族,其中包括人类的sarcolipin(30个氨基酸),这些肽展示了惊人的功能和结构保守性,追溯到约5亿年前。
1.4)smORFs与de novo基因进化
smORFs研究与de novo基因进化交叉,显示高达2%的编码基因无同源基因。研究认为,这些基因可能源于介于惰性DNA与完整蛋白之间的原始基因。
进一步假设,smORFs包含非编码原始基因和年轻编码基因,研究其系统发育变化或揭示新基因进化机制。
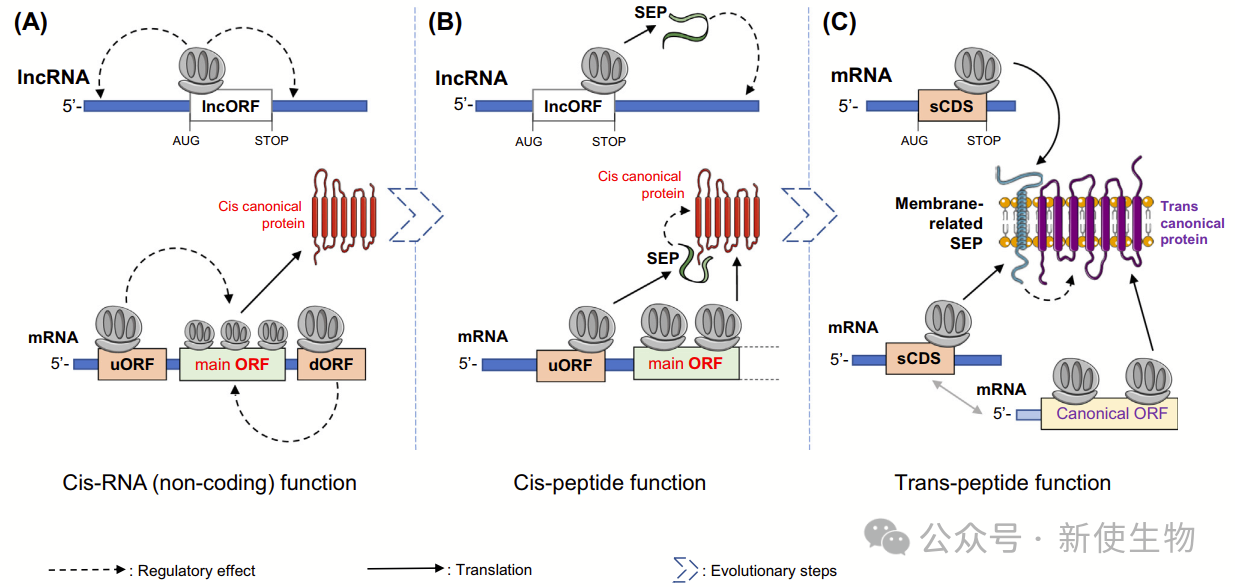
本文研究团队提出“顺式到反式路径”模型,解释非编码smORF如何转变为编码基因。
二. Ribo-seq技术:smORF检测的利器
ORFs随机出现在核酸序列中,仅凭存在无法证明其功能。要确认数万转录的smORFs中哪些具功能,需先确定其是否翻译。
传统的单基因方法(如遗传分析、报告基因检测)已被高通量测序技术补充。部分smORF编码肽(SEPs)通过蛋白质组学检测到,但仅仅高翻译水平的smORFs才容易被发现。
Ribo-seq核糖体印迹分析作为基因组范围内检测翻译的工具,有效地揭示了果蝇和脊椎动物中数百个smORFs的翻译,但是Ribo-seq仍因样本需求大、单基因聚焦和灵敏度低限制了其在基因组范围内的应用。
Ribo-seq显示sCDSs翻译效率(TE)高,与经典蛋白相当,而lncORFs和uORFs翻译较少且TE低。约30%的果蝇lncRNA含smORFs,可翻译保守性小肽,表明进化对smORF功能的重要性。虽多数lncORFs翻译随机,但部分经进化选择的smORFs具有功能。
三. 基因组层面smORF功能的探究
近年来,高通量测序与功能基因组学揭示smORFs功能。研究者发现大多数新短ORF无功能,但部分在应激下具适应性优势,支持“跨膜域优先”模型。果蝇研究表明少数smORF对线粒体功能关键。
有研究者在人类研究中通过Ribo-seq和CRISPR发现,部分uORF肽具反式功能,或与主要ORF协同调控翻译,展现双顺反子操纵特性,这些成果拓展了对smORF功能与进化的理解。
四. 单个smORF功能探究
单基因研究虽更能揭示smORF功能,但因突变靶点小、肽段不稳定,实施较难。然而,近期研究巩固既有趋势并提出新假设。
4.1)与膜相关的sCDS肽
许多小分子蛋白都涉及膜相关功能,支持smORF肽作为膜功能调节因子的角色:
1. Bouncer是一个80个氨基酸的小分子蛋白,促进物种特异性受精。
2. Kuduk编码的78个氨基酸跨膜蛋白与细胞骨架连接,调控LINC复合体连接细胞核与骨架。
3. Pegasus是一个80个氨基酸的分泌肽,调节Wingless/Wnt1信号扩散
4. Purriato是一个77个氨基酸的小分子蛋白,维持肌肉应激下蛋白稳态。
4.2)长非编码RNA编码的肽
长非编码RNA(lncRNA)编码的肽(lncORF)具有重要功能:
1. Linc-miprep 和 Linc-wrb:调节运动行为和神经发育,影响神经前体细胞。
2. pTUNAR:调节内质网钙离子水平,在不同细胞类型中发挥不同功能。
3. pTINCR:促进角质形成细胞增殖和上皮分化,抑制皮肤癌恶性度。
4. PACMP:增强化疗耐药性,通过维持CtIP稳定性和促进DNA修复。
这些肽在癌症研究中具有潜力,可作为新药物靶点。
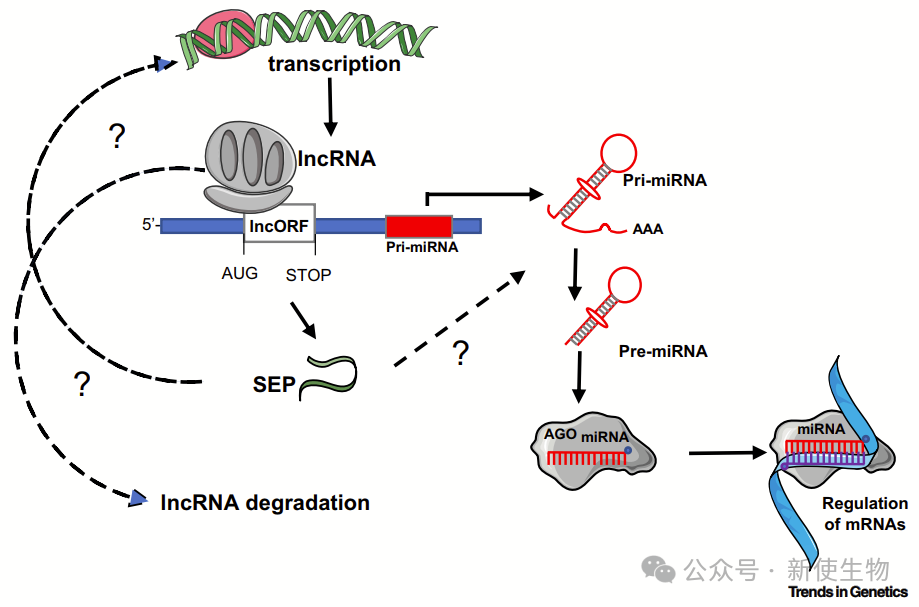
五. 顺式功能:一种通过非编码路径实现肽功能的方式
研究发现,与miRNA相关的lncORF翻译增强miRNA功能,作用机制在于翻译过程而非肽本身。
此结果支持smORF的顺式调控作用,并揭示从非编码到编码的演化路径,表明其在膜相关蛋白调控中具有重要意义。
总结
近期研究表明:1)smORF只有少数被翻译;2)在已翻译的smORF中,只有少数具有功能。尽管大部分smORF无功能或略有害,但它们仍可能作为新基因的进化来源。未来需深入探索非编码序列偏向及其与基因演化、生命起源的关系。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录杭州新使生物有限公司

感谢关注杭州新使生物,核糖体分析可咨询联系


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们