导读
DEAD-box ATP酶是调控RNA的关键蛋白,功能包括mRNA降解、核糖体生成、mRNA输出和翻译起始。它们被称为“RNA重塑因子”或“DEAD-box ATP酶”,而非传统的“DEAD-box解旋酶”。
翻译起始需酵母中的Ded1(哺乳动物中为DDX3)和eIF4A1(Tif1/2或DDX2A/B),主要通过扫描机制完成。起始复合物在eIF4F引导下结合mRNA 5'端,扫描至适合的起始密码子。
eIF4A促进所有mRNA翻译起始,而Ded1对5' UTR高度结构化的mRNA尤为重要,Ded1的缺失会降低翻译效率,且导致错误起始选择。
Ded1是应激颗粒核心成分,与应激条件下翻译和生长的抑制密切相关。Ded1的同源物Dbp1与其核心序列相似,但N端和C端差异明显,表达极低。
2024年12月17日,美国加州大学Gloria Ann Brar团队在Cell Reports上发表了一篇题为“Analyses of translation factors Dbp1 and Ded1 reveal the cellular response to heat stress to be separable from stress granule formation”的论文,发现了Ded1和Dbp1在翻译调控和应激反应中的差异性作用,为进一步研究RNA重塑因子在细胞生理中的多样化功能提供了重要线索。


文章索引
【发表日期】2024年11月17日
【IF】9.995
研究结果
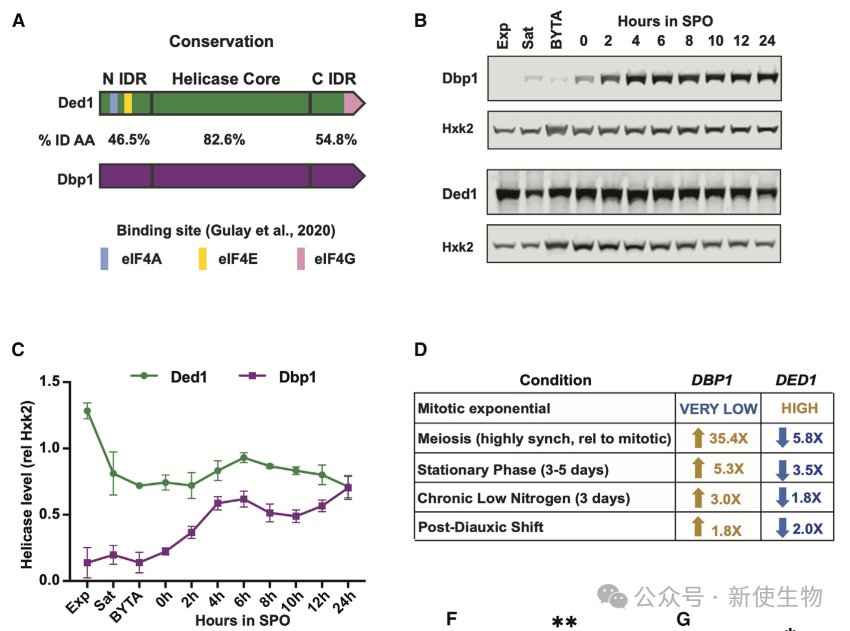
一. Dbp1和Ded1的表达呈负相关关系
Ded1在有丝分裂中高表达,Dbp1在减数分裂及营养匮乏时上调,伴随Ded1下降。Dbp1效率较低,替代成Ded1时5'UTR翻译及非AUG起始增加
二. 通过基因替换将DED1替换为DBP1揭示其在开放阅读框中的翻译差异
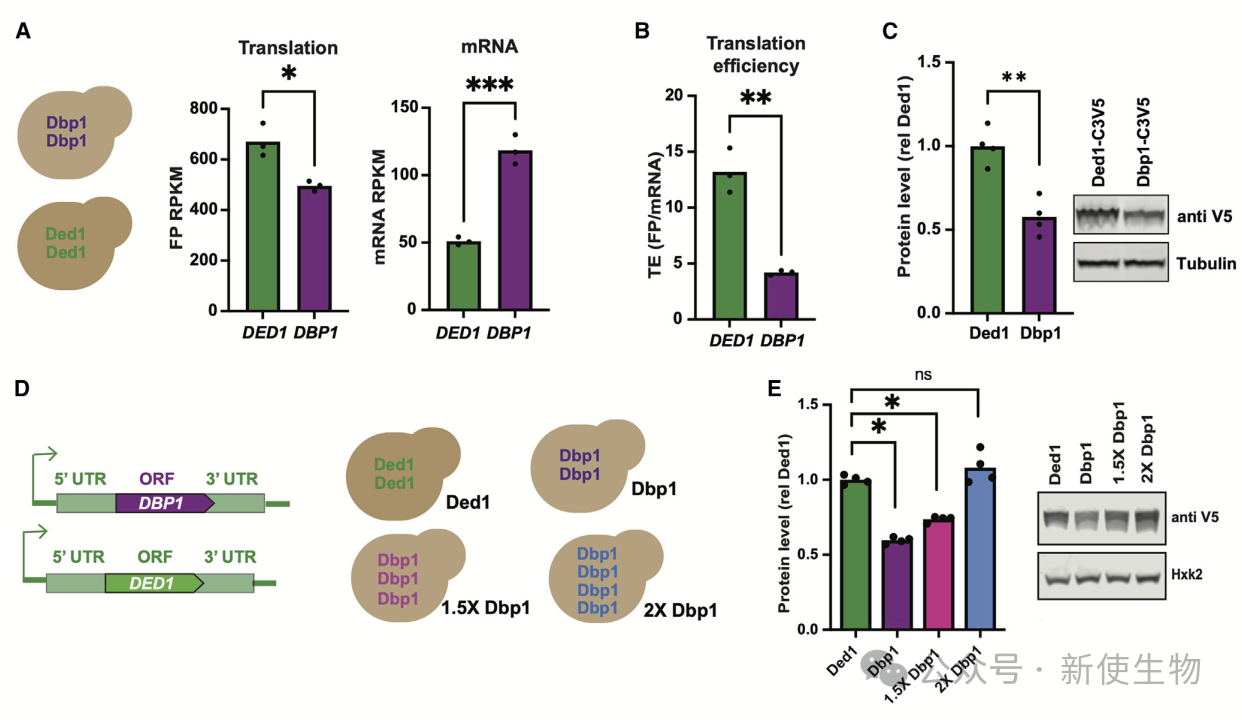
作者通过基因组替换实验探究了Dbp1是否能支持有丝分裂的指数生长。结果显示,Dbp1无法像Ded1那样有效支持翻译,导致细胞生长减缓和整体翻译减少。
通过Ribo-seq核糖体分析和Polysome profiling多聚核糖体分析,发现Dbp1在翻译起始区域的扫描能力较弱,翻译效率也低于Ded1。尽管Dbp1的mRNA水平高于Ded1,但其翻译效率不到Ded1的一半。
提高Dbp1表达可以部分恢复有丝分裂生长,表明Dbp1在特定条件下可以替代Ded1的功能。
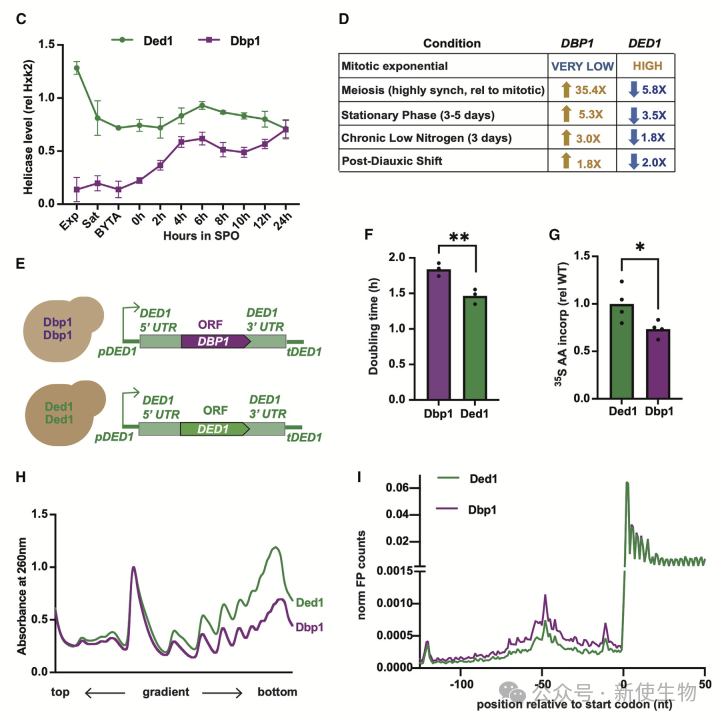
三. 在减数分裂中缺失Dbp1表达会导致Ded1表达上调
Ribo-seq核糖体印迹分析和mRNA-seq显示,缺失Dbp1的减数分裂细胞未见明显的减数分裂或翻译缺陷,但DED1的翻译显著增加,表明细胞通过上调Ded1来补偿Dbp1缺失。
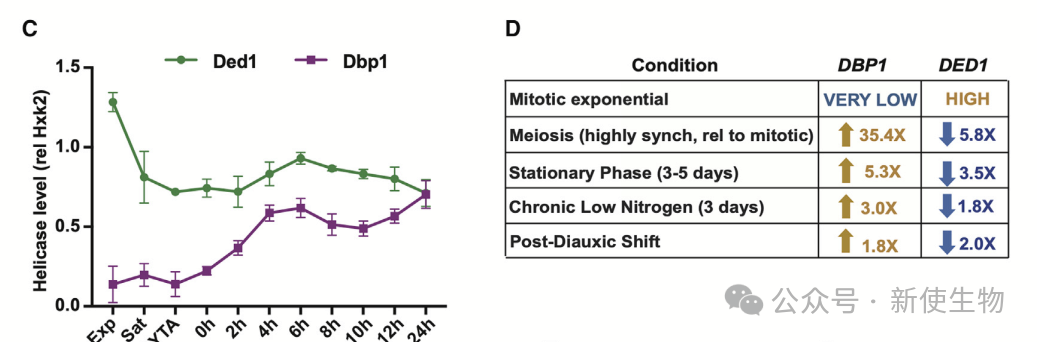
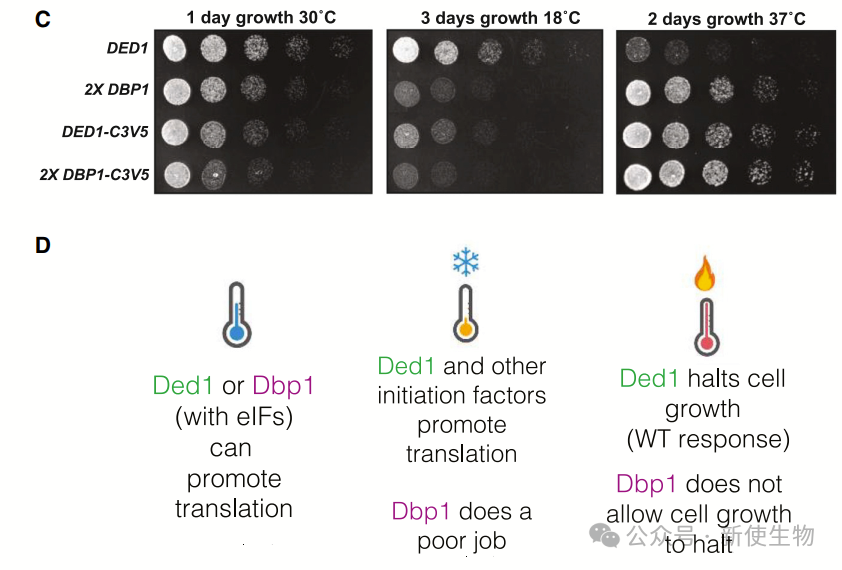
四. Dbp1无法在低温下支持细胞生长
在30°C下,Dbp1与Ded1的功能大致相同,但在18°C低温下,Dbp1表现出较差的翻译激活能力,导致生长缺陷。此缺陷在Dbp1拷贝数较少的细胞中更为严重。

五. Ded1的N端和C端的表位标签可能会影响其功能
Dbp1在18°C下的生长缺陷与Ded1类似,不论是否有3V5标签。然而,Ded1的N端或C端3V5标签会减缓细胞在18°C下的生长,可能是由于标签遮挡了其与eIF4F结合的位点。
六. Ded1与核糖体的结合效率高于Dbp1
Dbp1在低温下支持生长较差,可能因为其与扫描核糖体亚基的结合效率低,或翻译启动活性差。
质谱分析显示,尽管Dbp1在减数分裂细胞中总蛋白质水平较高,但其在翻译相关核糖体中的含量远低于Ded1。

七. 定位实验揭示Dbp1的翻译激活能力较弱
通过mRNA定位实验发现,Dbp1的翻译激活能力低于Ded1,主要由其N端和C端决定。减数分裂细胞中,Ded1仍优于Dbp1。

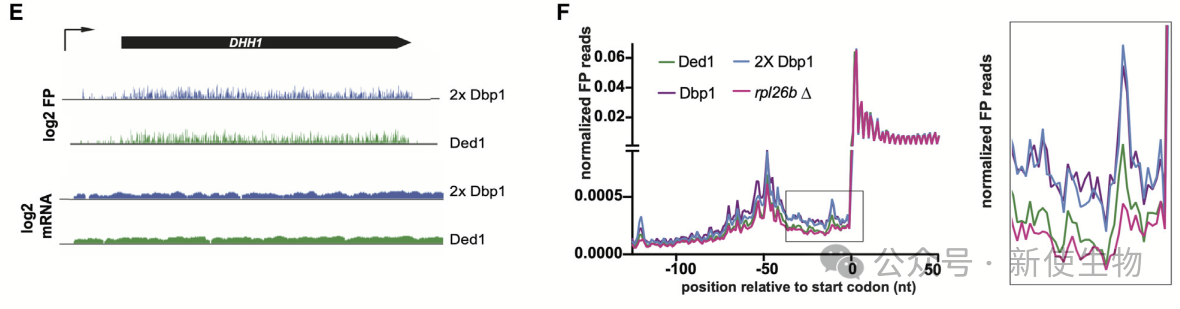
八. 替换Ded1为Dbp1会在有丝分裂中导致5'端翻译的增加
通过Ribo-seq核糖体印迹分析,作者发现表达低水平或匹配Ded1水平的Dbp1的细胞在5'端区域积累核糖体足迹,表明Dbp1在促进翻译起始方面不如Ded1有效。
这个效应在部分高表达转录本(如DHH1)和整体ORF分析中均有体现,且不能仅通过总体翻译量减少来解释。
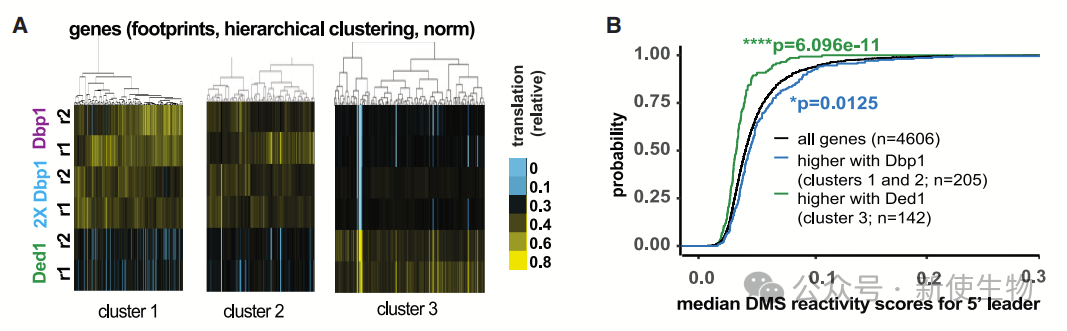
九. 含有结构化5'领导区的mRNA通过Ded1的翻译效率高于Dbp1
Ded1在启动翻译,特别是具有结构化5'领导区的mRNA时比Dbp1更有效。虽然Dbp1替代Ded1表达时在有丝分裂细胞中增强了5'领导区的翻译,但总体上Dbp1在翻译启动方面不如Ded1高效。
通过Ribo-seq核糖体印迹分析和mRNA测序,作者发现翻译水平较高的mRNA主要富含结构化的5'领导区,进一步证明了Ded1在翻译这些区域时的优势。
十. Dbp1表达的细胞在热诱导抑制管家基因翻译方面存在缺陷
在高温下,Dbp1表达的细胞生长良好,而Ded1表达的细胞生长受限。
Ribo-seq核糖体印迹分析显示,Dbp1主要翻译高度结构化5'端领区的管家基因,而Ded1在高温下更有效地促进这些基因的翻译,支持细胞生长。
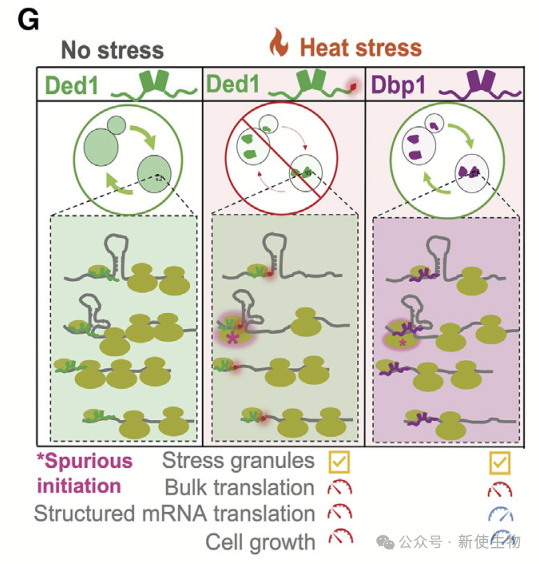
十一. Dbp1和Ded1在热应激下都会形成应激颗粒,并减少整体翻译
作者发现Dbp1和Ded1在热应激下都会形成应激颗粒,但Dbp1表达细胞不会像Ded1表达细胞那样停止生长。
虽然两者都导致整体翻译减少并形成应激颗粒,但只有Ded1表达细胞表现出结构化管家转录本翻译受抑制和生长减缓。
数据表明,高温应激下的翻译抑制和生长抑制依赖于Ded1,而应激颗粒形成和整体翻译下降则与Ded1无关。
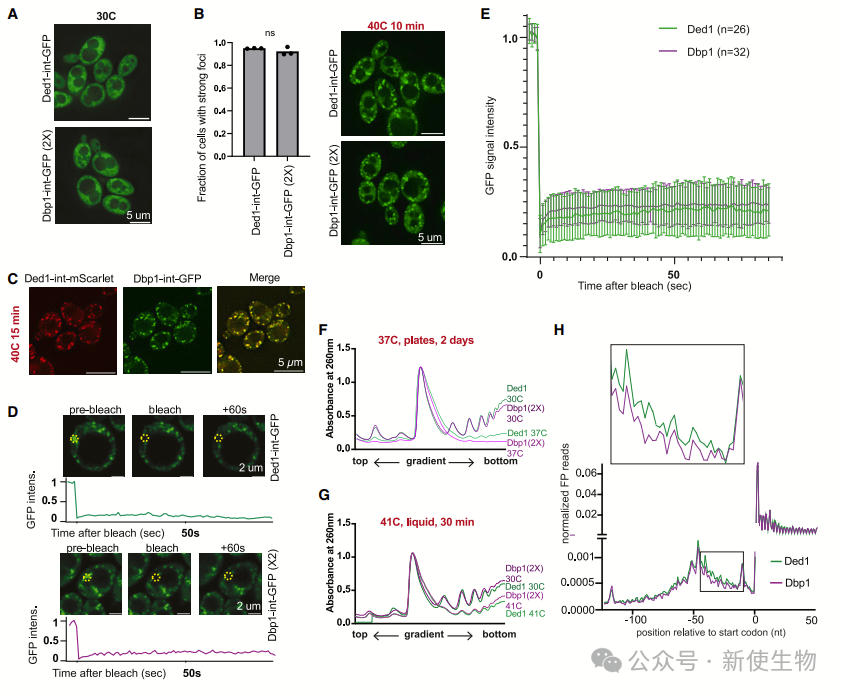
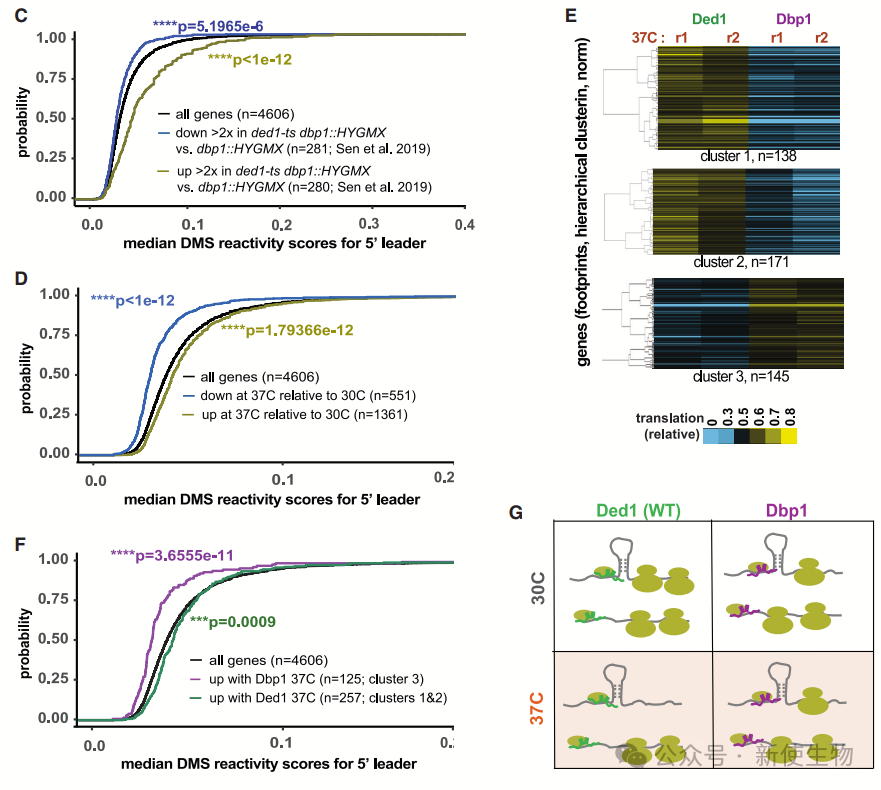
十二. Ded1在热应激下表现出选择性的功能变化
研究发现,Dbp1表达细胞在热应激下能持续生长且未抑制结构化的管家基因转录本,而Ded1表达细胞则停止生长,并表现出功能丧失。
热应激下,Ded1在促进翻译方面不再优于Dbp1。进一步分析表明,Ded1和Dbp1在高温下形成的凝聚物性质不同,Ded1凝聚物变得不规则,而Dbp1凝聚物保持平滑、球形。
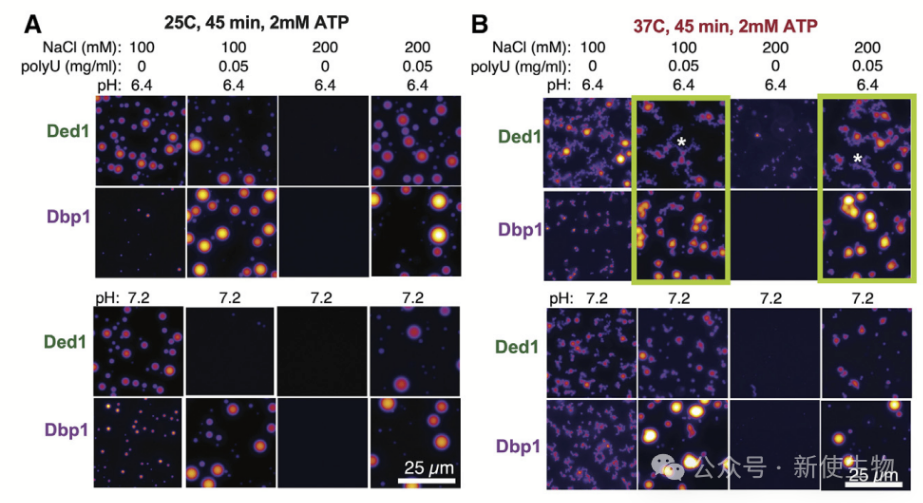
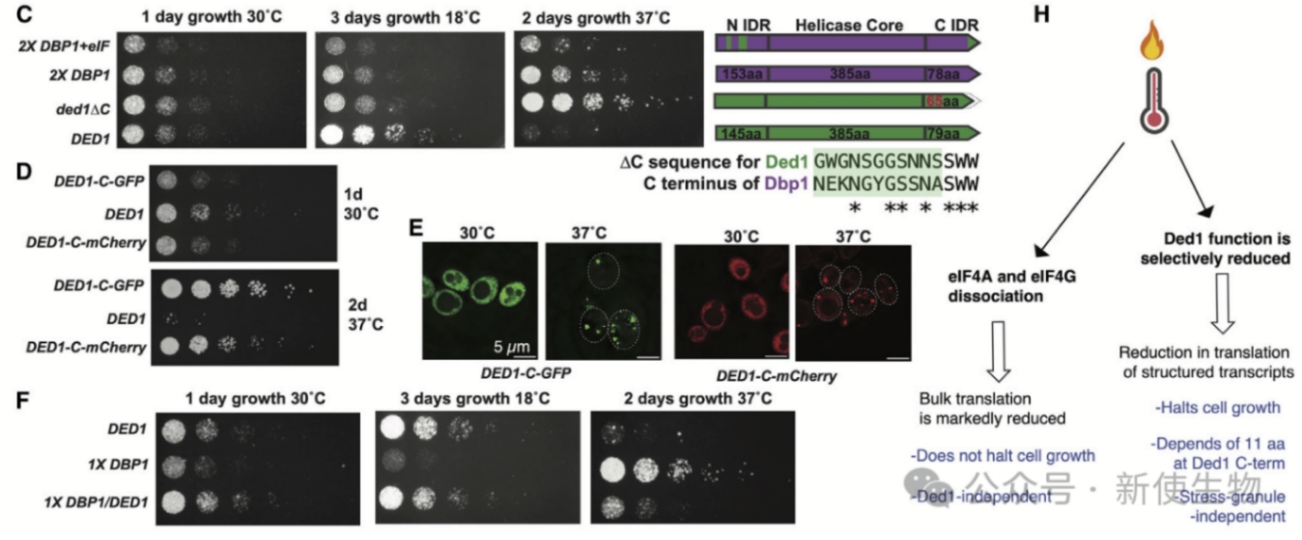
十三. Ded1 C末端的11个氨基酸区间介导其在热应激中的作用
Ded1在高温下发生结构变化,导致其功能转变。研究发现,Ded1和Dbp1在热稳定性上相似,但Ded1的C末端对于翻译激活至关重要。
缺失Ded1 C末端14个氨基酸的变体在37℃下与Dbp1相似,表现出良好的生长,而完整的Ded1则在37℃下无法有效促进翻译。
结果表明,Ded1功能转变并非影响其与mRNA结合,而是导致其无法有效激活翻译。
总结
Ded1和Dbp1是参与翻译起始的DEAD-box ATP酶。在热应激下,Dbp1表达的细胞不会像Ded1表达的细胞那样停止生长,原因是Ded1功能的丧失。尽管两者的蛋白水平相同,Ded1在激活翻译方面优于Dbp1,尤其是对于结构化的 5'端mRNA。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可联系杭州新使生物

感谢关注新使生物,翻译组测序可以联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们