导读
转座子(TEs)是哺乳动物基因组的重要组成部分,一些转座子通过插入破坏邻近基因表达,对基因组完整性构成威胁,同时显著影响基因转录和染色质状态。
在雄性小鼠生殖细胞中,TE过度激活与减数分裂失败和男性不育密切相关,其活性通过DNA甲基化、组蛋白修饰及PIWI-piRNA介导的沉默机制严格调控。然而,TEs的转录后调控机制仍需深入研究。
RNA外切体是3’→5’方向的RNA降解复合物,由核适配体(如NEXT复合物)引导,靶向多种RNA底物,包括转座子RNA(TE RNAs)。NEXT复合物核心因子ZCCHC8与家族性肺纤维化、端粒酶成熟和神经疾病相关,其敲除会导致小鼠生育力下降。
研究表明,ZCCHC8通过降解LINE1转录本,调控早期胚胎染色质开放性,其与m6A读取蛋白YTHDC1及HUSH复合物协作,支持TE位点的H3K9me3修饰,维持染色质稳定。因此,ZCCHC8在精子发生中的染色质调控机制值得深入探索。
2024年12月17日,同济大学高亚威、吴悠和高绍荣团队在National Science Review上发表了一篇题为“Core factor of NEXT complex, ZCCHC8, governs the silencing of LINE1 during spermatogenesis”的论文,发现关键的核RNA衰减因子NEXT复合物在RNA和表观遗传水平上调控逆转录转座子,揭示了精子发生过程中逆转录转座子沉默的新机制。
文章索引
【发表日期】2024年12月17日
【IF】15.58
研究结果
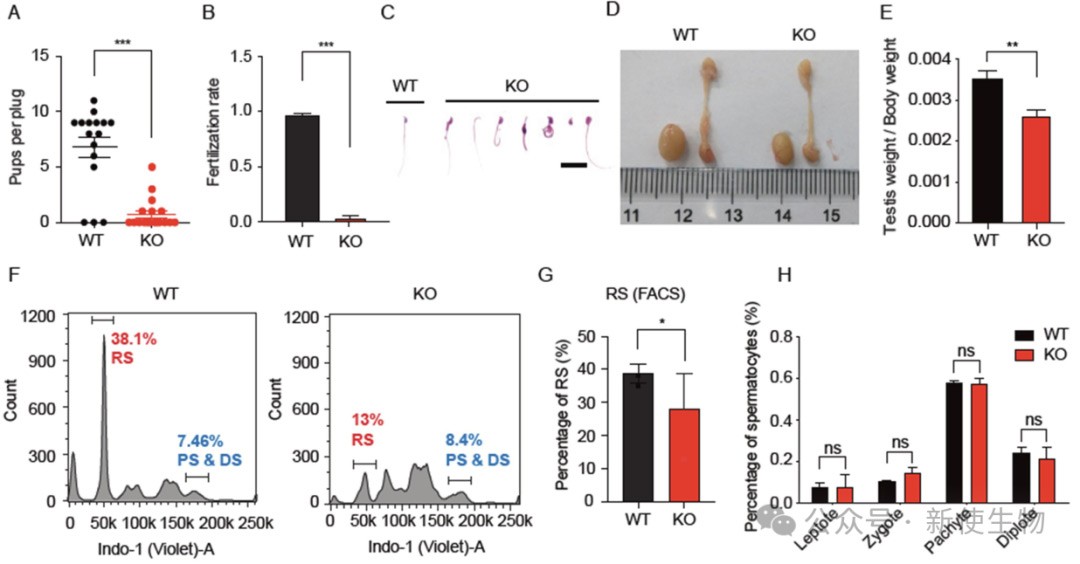
一. Zcchc8敲除的雄性小鼠生殖缺陷
Zcchc8敲除导致精子数量减少、活力下降、圆形精子生成受阻及睾丸细胞凋亡增加,缺陷集中在减数分裂后期。
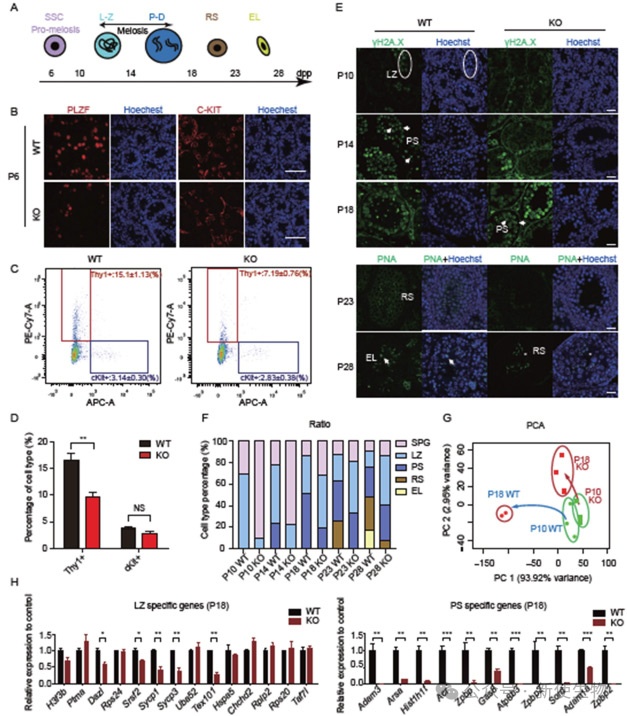
二. Zcchc8敲除小鼠的首次精子发生延迟
Zcchc8敲除小鼠首次精子发生延迟,未分化精原细胞减少,减数分裂进程推迟,基因表达紊乱,尤其是粗线期和圆形精子阶段受影响明显。
三. Zcchc8敲除小鼠的精原干细胞和精母细胞中年轻L1元件水平升高
ZCCHC8缺失导致精原干细胞和精母细胞中LINE1等转座子RNA上调,而圆精子中无明显变化。
免疫染色显示LINE1 ORF1蛋白在精母细胞中升高。RNA-seq分析发现L1Md_A在KO细胞中显著上调,piRNA水平未受显著影响,表明ZCCHC8通过非piRNA通路调控L1沉默。
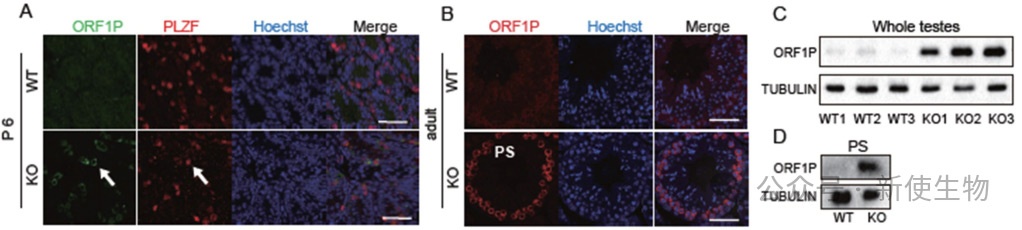
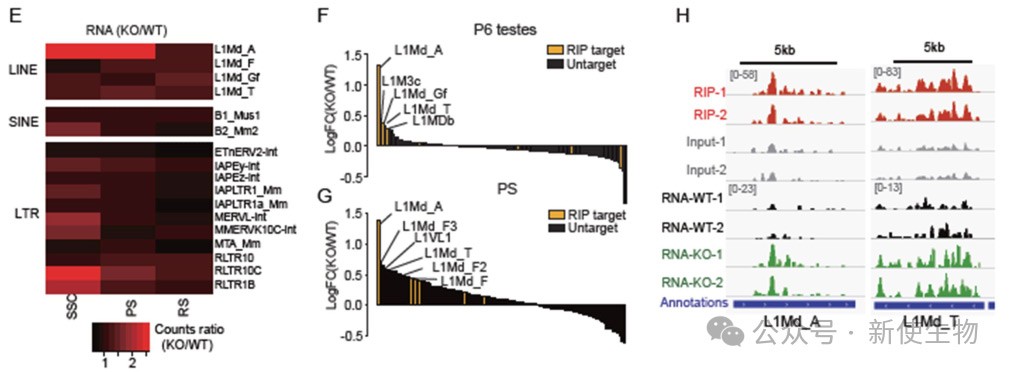
四. ZCCHC8靶向精原干细胞和精母细胞中的年轻L1转录本
作者使用RIP-seq分析了ZCCHC8在精子发生中的靶向转座子转录本。
结果显示ZCCHC8能结合LINE RNA,尤其是年轻的L1亚家族,如L1Md_A、L1Md_T和L1Md_Gf,且这种结合在精母细胞(PS)中具有选择性亲和力。ZCCHC8通过直接靶向这些转录本,抑制年轻L1亚家族的表达。
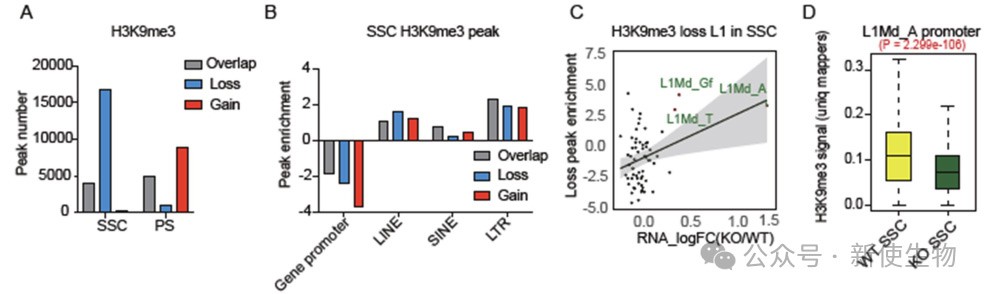
五. ZCCHC8缺失导致精原干细胞中年轻L1元素的H3K9me3丧失
研究发现,ZCCHC8在精子发生过程中调控逆转座子(TE)上的H3K9me3修饰。
在Zcchc8 KO小鼠的精原干细胞(SSC)中,H3K9me3修饰显著减少,主要集中在年轻的L1元素上,而在精母细胞(PS)中则出现峰值增加。这表明ZCCHC8对精原干细胞中的H3K9me3修饰至关重要,且随着减数分裂的进行,可能由其他因子补偿这一缺失。
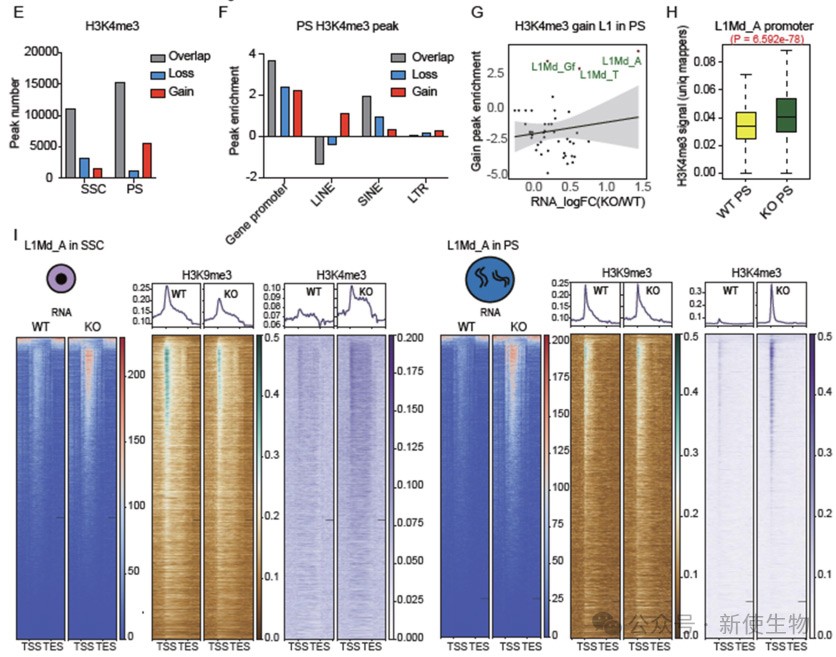
六. ZCCHC8缺失导致年轻L1元素上H3K4me3水平增加
Zcchc8 KO小鼠在精子细胞中L1元素的H3K4me3修饰显著增加,尤其在PS阶段,L1Md_A亚家族表现突出。
SSC和PS中L1Md_A启动子区域的H3K4me3信号显著上升,提示Zcchc8缺失可能通过H3K4me3修饰调节年轻L1元素的表达。
七. 在ZCCHC8缺失的精子细胞和精子形态发生细胞中,L1Md_A的染色质可及性增强
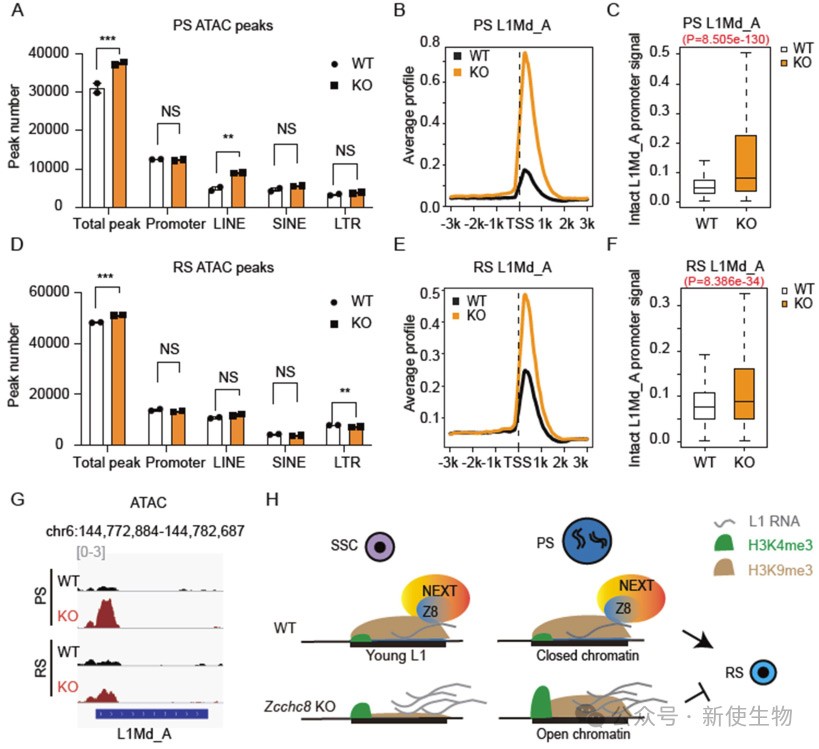
ZCCHC8缺失导致精子细胞在PS到RS的后期减数分裂中染色质凝缩受损。
ATAC-seq分析显示,KO小鼠在PS和RS阶段L1区域的染色质可及性显著增加,尤其是在L1Md_A启动子区域。这种染色质可及性的增加可能影响精子成熟,导致减数分裂效率降低。
总结
本文发现ZCCHC8通过NEXT复合物在精子发生中沉默转座子元素(TEs)。ZCCHC8缺失导致减数分裂延迟和圆形精子细胞减少,L1Md_A等转座子在精原干细胞和前期精子细胞中上调,染色质修饰异常,可能影响精子发生。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们