导读
外源mRNA引入细胞后可表达目标基因(GOI),构成了mRNA治疗的基础。然而,由于不稳定性、高免疫原性和低效递送等问题,其发展进展缓慢。尽管核苷酸修饰和RNA递送技术推动了mRNA疫苗的成功,mRNA的不稳定性仍制约了其他应用。
环状RNA(circRNA)因抗外切酶而更稳定,是mRNA疗法的潜在替代品。天然circRNA既可作为microRNA和蛋白质的海绵,又可作为翻译模板。在内部核糖体进入位点(IRES)支持下,circRNA可高效翻译。
无终止密码子的circRNA可通过滚环翻译(RCT)生成多蛋白质,效率理论上比单次翻译高100倍,但面临两个问题:起始效率低和环化引入附加序列。
circRNA可通过化学、酶促连接或基于I型内含子的置换内含子–外显子(PIE)方法体外合成。其中PIE效率较高,但存在长RNA低产量、免疫原性及无法合成修饰circRNA等局限性。
circRNA的鉴定同样存在挑战,现有方法多受限于分离效果、长度或批次间差异,需要更通用可靠的检测手段。
2024年12月13日,英国剑桥MRC分子生物学实验室V. Ramakrishnan团队在Nature Biomedical Engineering上发表了一篇题为“Efficient circular RNA synthesis for potent rolling circle translation”的论文,报告了高效且精确的circRNA合成技术,以及用于探究circRNA的简单分析方法,为circRNA在治疗应用中的潜在价值提供了支持。

文章索引
研究结果
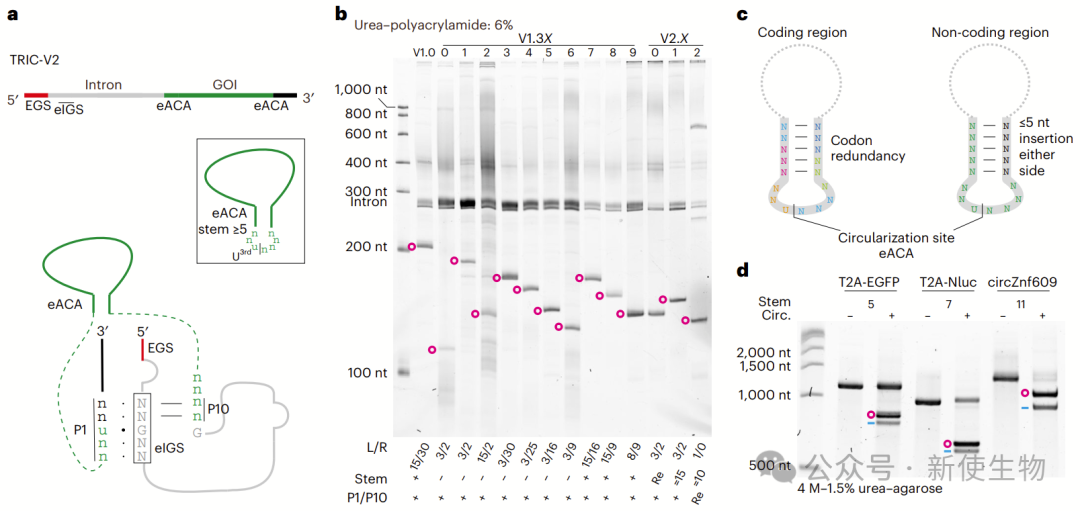
一. TRIC高效合成环状RNA
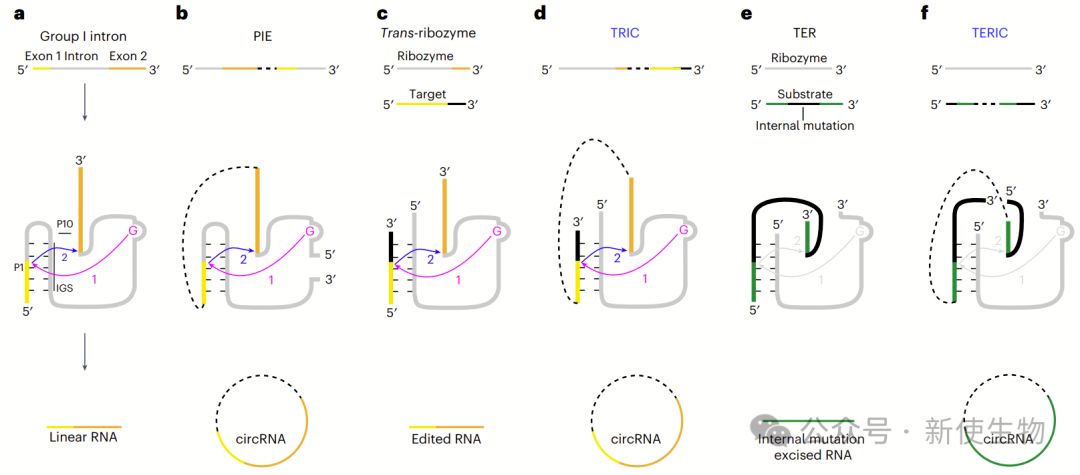
I型内含子可作为反式核酶,通过连接目标序列3′端实现环化(TRIC)。
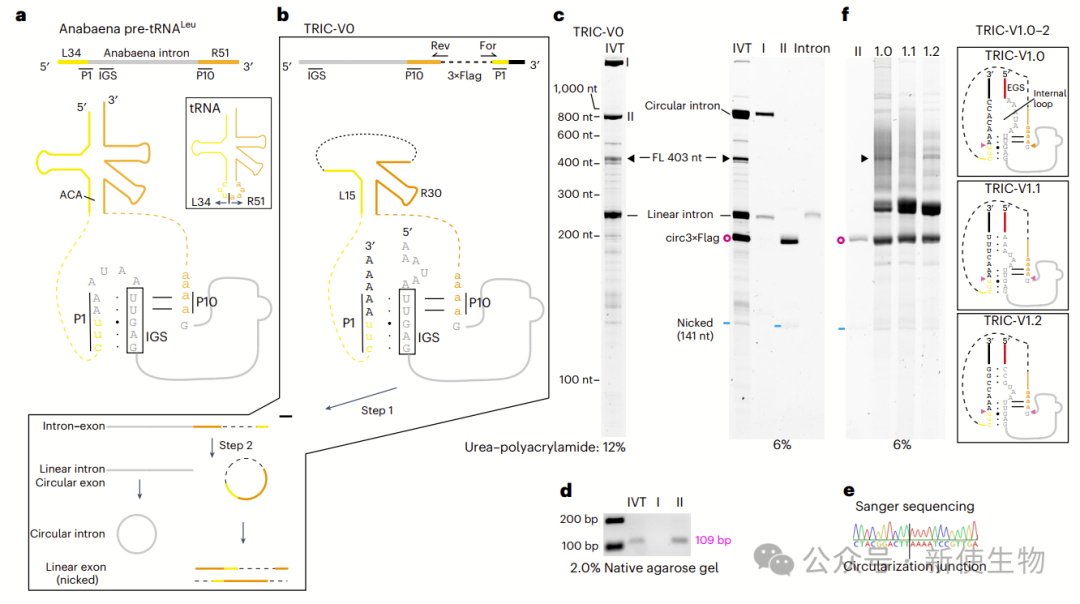
作者选用活性高、序列短的Anabaena tRNALeu内含子,设计TRIC-V0环化3×Flag序列,并通过凝胶、洗脱、RT-PCR和测序确认其环状结构。
另外,他们引入延伸引导序列(EGS)和内环优化为TRIC-V1,进一步提高环化效率,其中V1.0表现最佳,用于后续的优化。
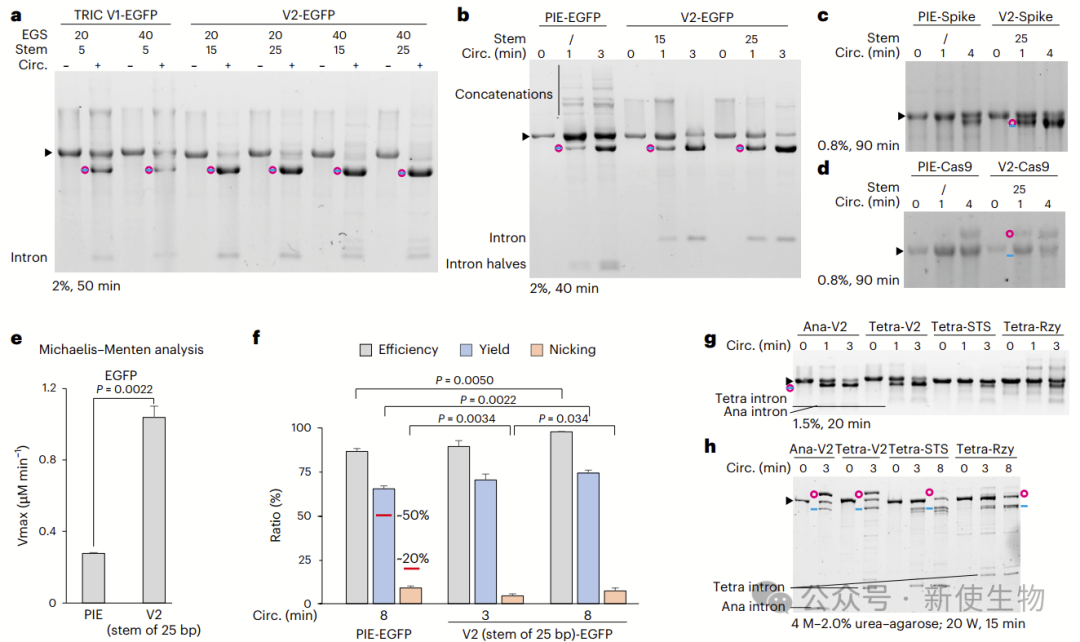
二. 新方法实现超过8000 nt环状RNA的合成
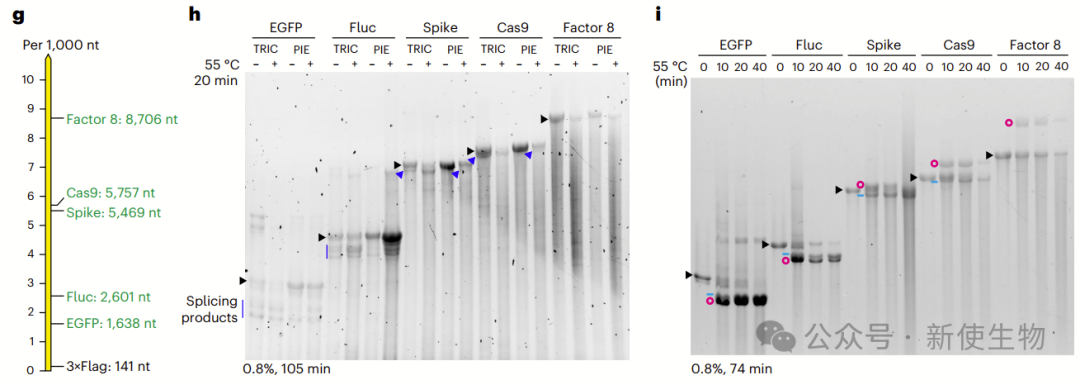
V1.0在环化长目标基因(GOI)方面效率高于PIE,尤其对>8000 nt的RNA表现出优异性能。
作者通过降低Mg²⁺浓度抑制共转录环化,可有效减少RNA断裂。转录后环化是合成>5000 nt环状RNA的关键步骤,V1.0和PIE在短时环化效率上相当,但PIE难以生成超长环状RNA。
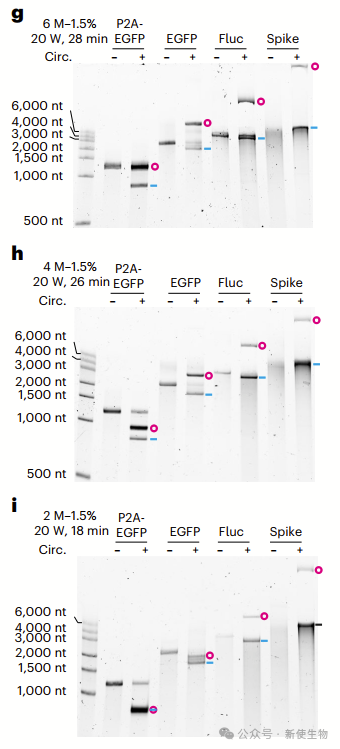
三. 天然琼脂糖凝胶可将环状RNA与其线性对应物分离
天然琼脂糖凝胶可有效分离环状RNA与线性RNA,环状RNA迁移速度较快。随着琼脂糖浓度增加,分离效果增强,3%凝胶中环状RNA迁移较慢,通过RNase R消化可以确认其环状特性。

四. 尿素-琼脂糖凝胶系统能有效分离环状RNA与其线性对应物
在变性尿素–琼脂糖凝胶中,环状RNA比线性RNA迁移得更慢,分离效果随尿素和琼脂糖浓度增加而增强。
延长电泳时间或提高功率有助于提高分离效果,这是一种快速鉴定环状RNA的方法。
五. TRIC-V2 实现了RNA环化而无需引入不必要的序列
理想的TRIC构建应具备最小序列需求并保持高效性。V2构建通过改变结构而非序列,能高效环化,无需原生剪接序列,最小需求为7 nt环和≥5 bp茎,该方法可有效环化长蛋白编码circRNA,且易于工程化。
六. TRIC-V2比PIE更快速
V2(25 bp 茎环)环化效率显著优于PIE,1分钟转化超半数线性RNA,8分钟效率达97.8%,产率74.8%,这一优化方案可推广至其他I类内含子。
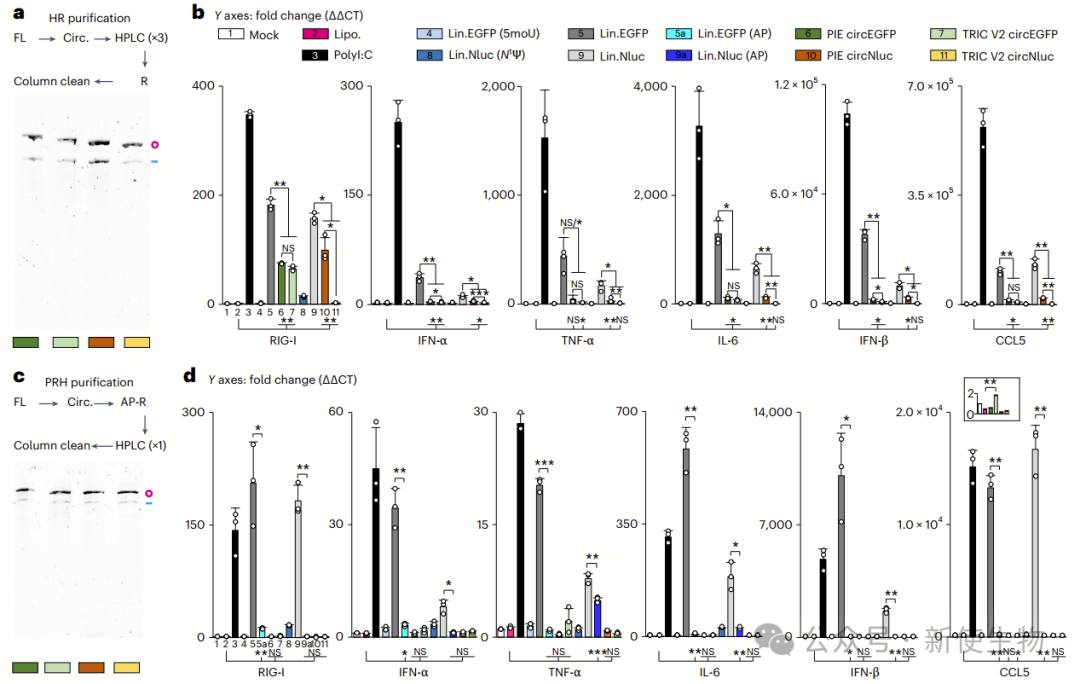
七. 环状RNA的免疫原性较低
环状RNA免疫原性较低,但V2与PIE环状RNA差异尚不确定。
优化纯化后,PRH纯化的环状RNA几乎无免疫反应,支持环状RNA免疫原性低的观点。
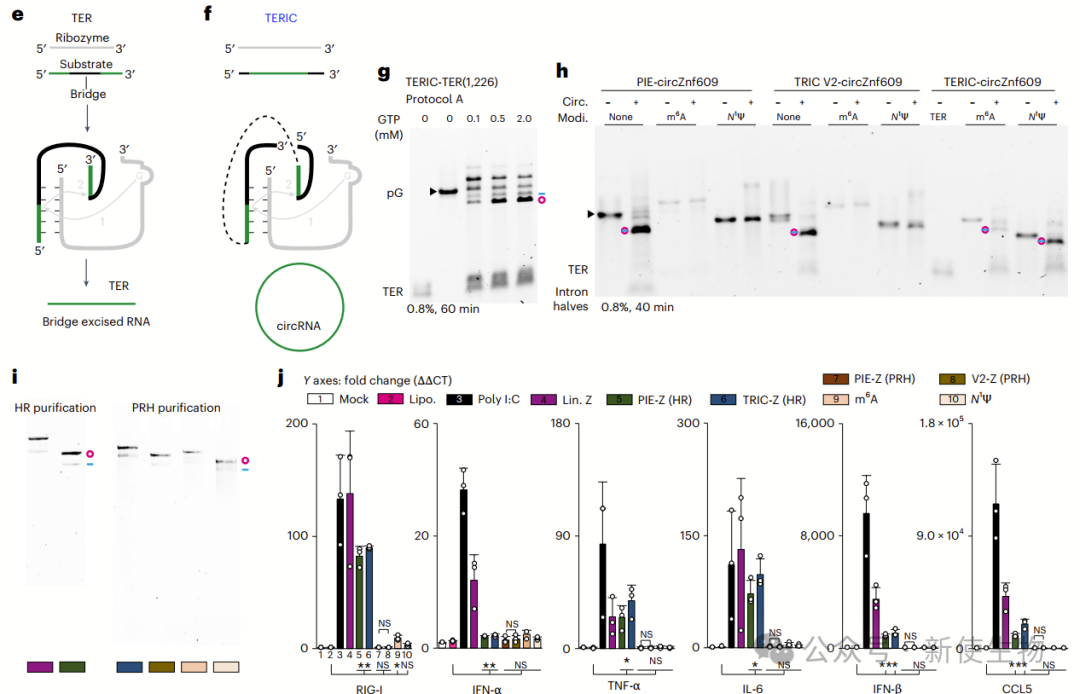
八. 改良环状RNA的合成与免疫原性
TERIC技术可高效合成100%修饰的环状RNA,解决了PIE和TRIC无法实现的问题。修饰的环状RNA显著降低免疫原性,但m6A修饰仍可能诱导部分RIG-I表达。
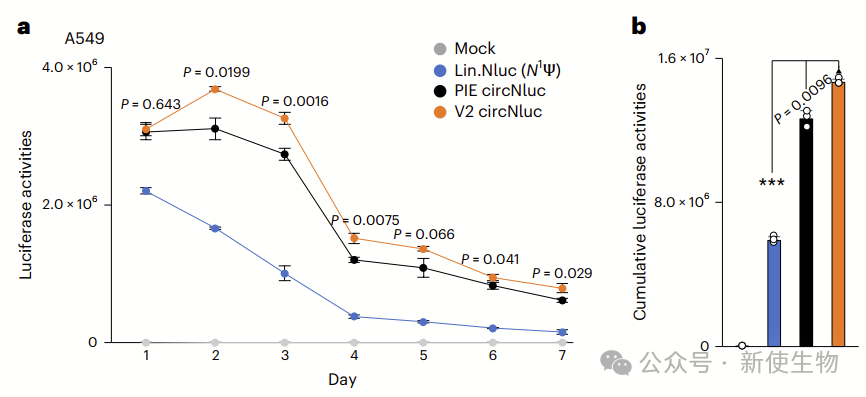
九. TRIC circNluc产生的蛋白质比PIE circNluc多
TRIC circRNA(V2 circNluc)在A549细胞中的蛋白表达在第2天达到峰值,并且在第3天仍显著高于第1天,而PIE circNluc表达在第1天达到峰值后没有再增加。
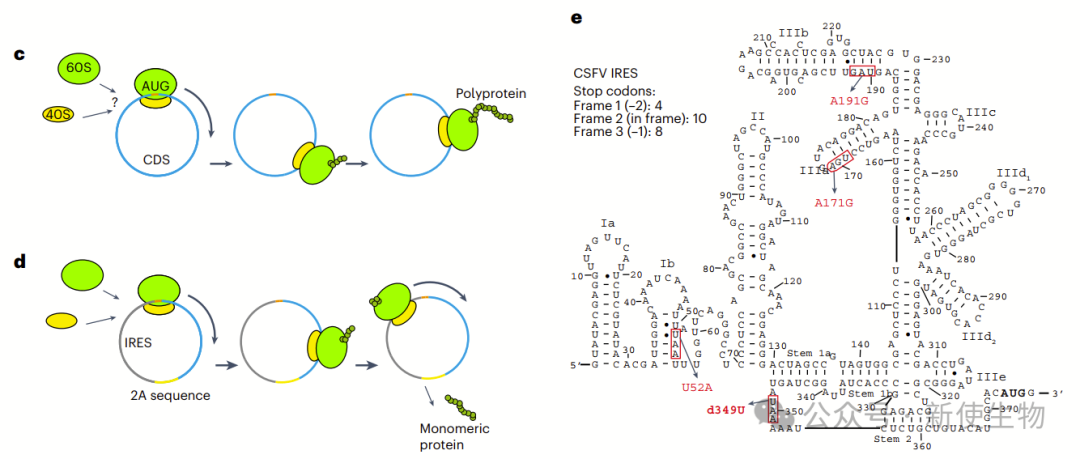
十. RCT的翻译效率提高了超过7000倍
RCT主要生成多肽蛋白,可以通过2A跳跃序列转化为蛋白单体。使用强效短IRES(OR4F17)构建的circOR4F17-Nluc-RCT生成了大量蛋白,但效率低于N1Ψ修饰的mRNA。
作者测试了CSFV IRES后,发现去除停顿密码子的设计使得RCT的翻译效率比OR4F17 IRES提高了7000倍。
总结
本文介绍了一种合成方法,可高效合成超过8000个核苷酸的circRNA,且不依赖细菌序列。此方法比传统的内含子-外显子重排方法效率更高,且生成的circRNA具有低免疫原性和较高的翻译效率,促进了circRNA的治疗应用潜力。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
