导读
核糖体被认为是高度精确的代码读取机器,翻译效率主要由mRNA的序列和结构以及翻译因子活性决定。大多数mRNA通过帽依赖机制启动翻译,由约30种真核起始因子(eIFs)控制。
近年来,核糖体功能多样化的认识逐步深入,有部分核糖体蛋白(RP)被认为是可缺失的,只对特定mRNA翻译必需。RP的旁系同源物表达、亚基比例变化以及翻译后修饰(PTM)均可导致核糖体功能和结构多样化。
病毒感染展示了核糖体调控的独特场景。病毒完全依赖宿主翻译系统,采用多种策略劫持核糖体,如通过破坏eIF活性抑制宿主翻译,同时利用非经典机制合成病毒蛋白。
A)RNA病毒的IRES元件可直接与eIF3或核糖体结合,绕过eIF4F需求,实现核糖体加载和翻译起始。
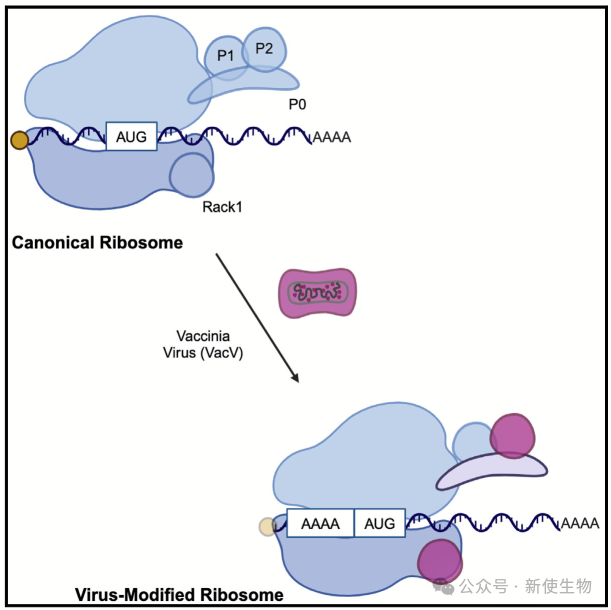
B)DNA病毒对核糖体蛋白(RP)的依赖了解较少,但比如HSV-1可通过病毒蛋白补偿RP不足,痘病毒则可通过磷酸化RACK1调控后期蛋白合成。此外,痘病毒早期通过帽依赖翻译,后期则依赖多腺苷酸领导序列进行帽非依赖翻译。
这些发现揭示了核糖体在病毒感染中的结构和功能适应性。
2025年1月9日,美国西北大学Derek Walsh团队在Cell Reports上发表了一篇题为“Ribosome customization and functional diversification among P-stalk proteins regulate late poxvirus protein synthesis”的论文,揭示痘病毒感染如何改变核糖体结构,定义感染中早期和晚期mRNAs的RP依赖性,并发现了RACK1和RPLP2等RP在促进病毒后期蛋白合成中的关键作用。这些发现表明痘病毒如何通过改变核糖体结构以及利用传统上非必需的RPs优化病毒mRNA的翻译起始效率。

文章索引
【发表日期】2025年1月9日
【IF】9.995
研究结果
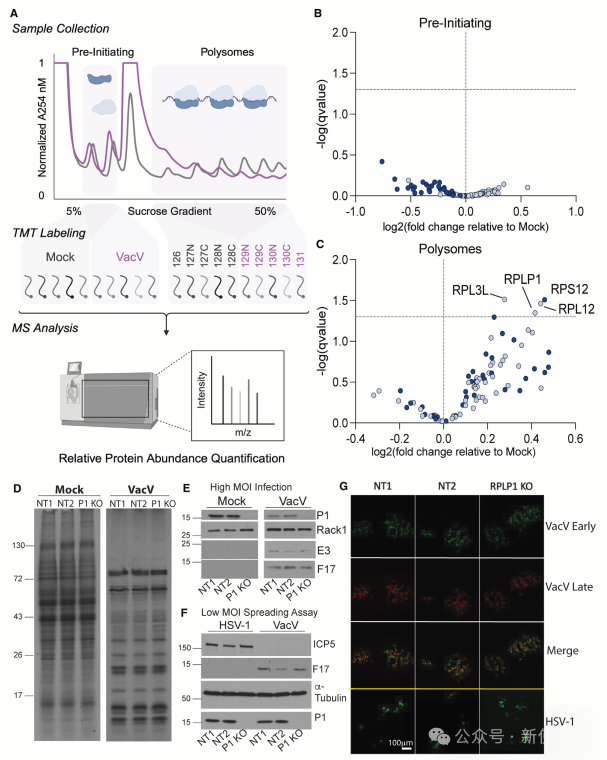
一. 定量质谱揭示痘病毒感染细胞中预起始和活跃翻译核糖体RP组成的有限变化
作者通过GFP标记的RACK1和蛋白质组学分析痘病毒VacV感染期间核糖体组成,结果显示核糖体 RP 亚基在感染期间无显著变化。
Polysome profiling多聚核糖体分析进一步精确量化40S、60S和多聚核糖体中的RP丰度,发现感染组中多聚核糖体有4个RPs略有升高,但无统计显著性。
CRISPR敲除RPLP1表明其缺失对病毒蛋白合成、翻译模式和病毒复制无影响,证实感染期间核糖体RP组成稳定,RPLP1是非必需的。
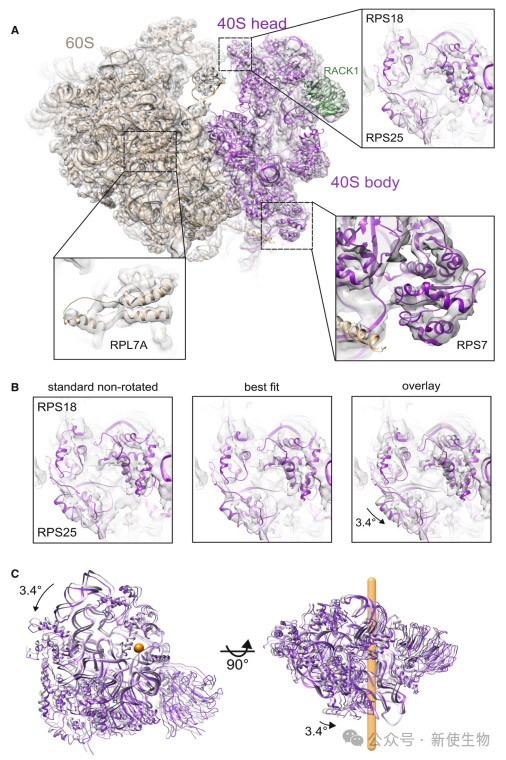
二. VacV感染导致组装的80S核糖体中40S旋转状态偏移并改变40S头部摆动
VacV感染导致80S核糖体中40S亚基的旋转状态比例显著偏高,并伴随40S头部额外3.4°的摆动。
这些变化由RACK1等蛋白的翻译后修饰驱动,与翻译增强和支持非经典起始模式相关。
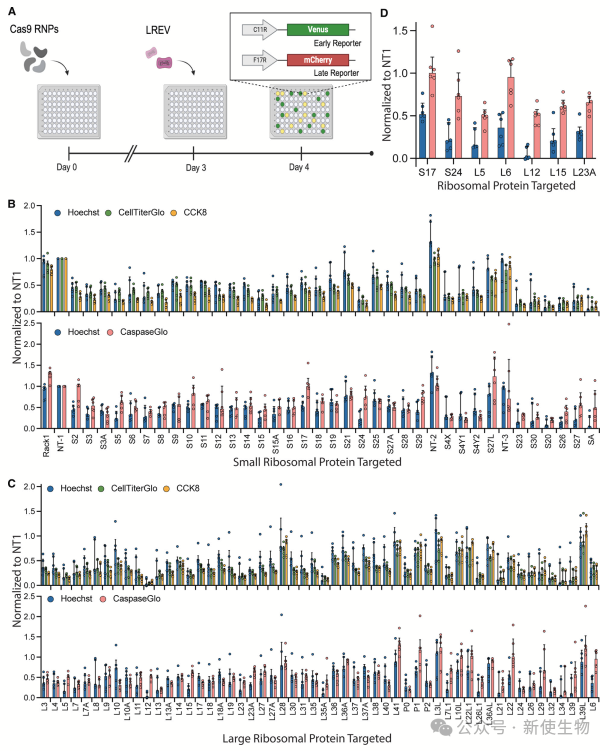
三. 以核糖体为中心的敲除筛选揭示痘病毒感染期间的特定RP依赖性
作者通过CRISPR敲除筛选测试了核糖体蛋白(RP)对痘病毒早期和晚期蛋白合成的影响。
结果发现,RACK1在晚期病毒蛋白合成中起重要作用,而对早期蛋白的影响较小。其他一些RP,如RPL8、RPL7A、RPL10等,主要影响晚期蛋白合成,并伴随细胞代谢的变化。
此外,RPL38敲除对晚期蛋白合成有显著影响,但对早期合成影响较小。
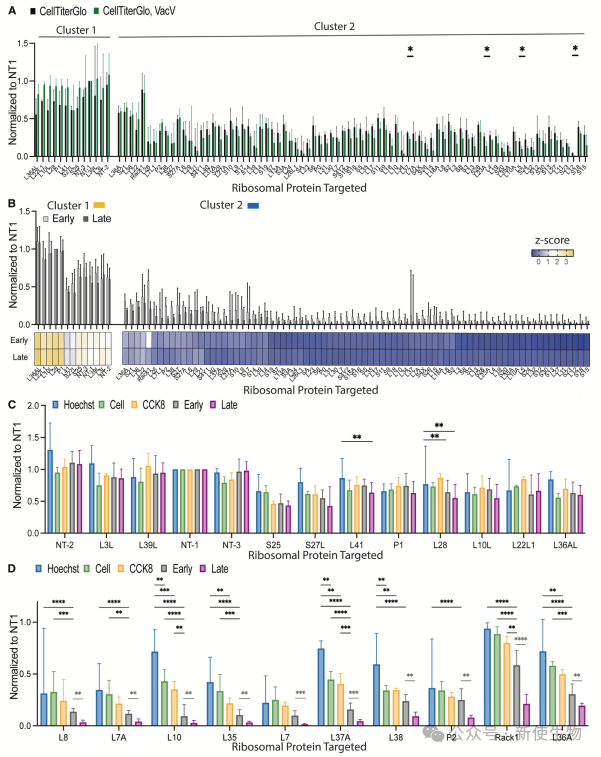
四. P-茎亚基RPLP2选择性调控晚期痘病毒蛋白的合成
RPLP2缺失导致晚期病毒蛋白表达显著下降,但不影响早期病毒蛋白或细胞代谢活性。
作者进一步分析P-茎组件,发现核心锚定亚基RPLP0对早期和晚期病毒报告基因的表达是必需的,而RPLP1和RPLP2在全局蛋白质合成中通常不是必需的。RPLP2专门在晚期病毒蛋白的合成中起作用,这一作用在不同细胞系和病毒中表现出特异性。
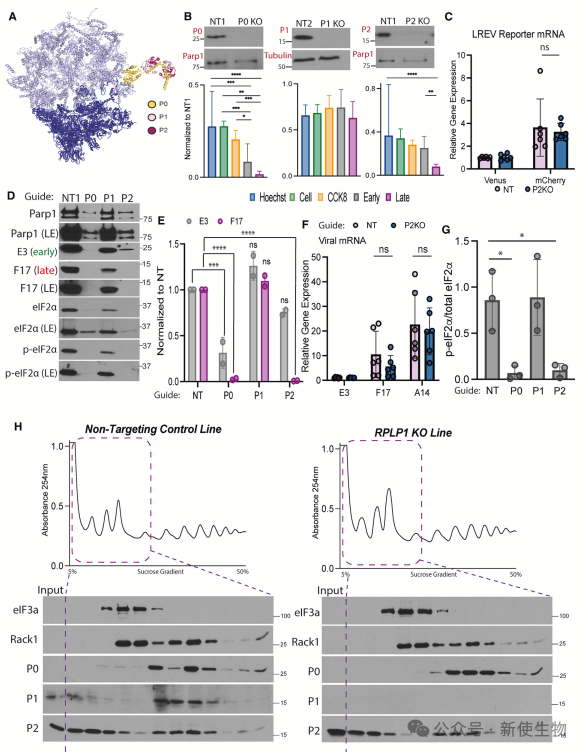
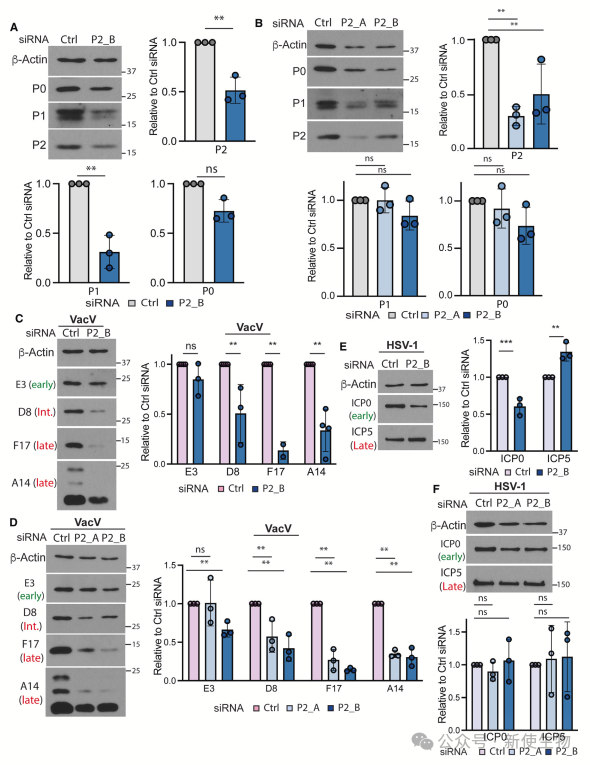
总结
本研究表明,病毒通过定制核糖体并依赖传统上非必需的核糖体亚基蛋白,如RACK1和RPLP2,来特异性调控晚期mRNA的翻译。RPLP0对全局翻译必需,而RPLP2则专门促进晚期病毒蛋白的合成。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
