
文章索引
【发表日期】2025年4月7日
【IF】14.7
研究结果
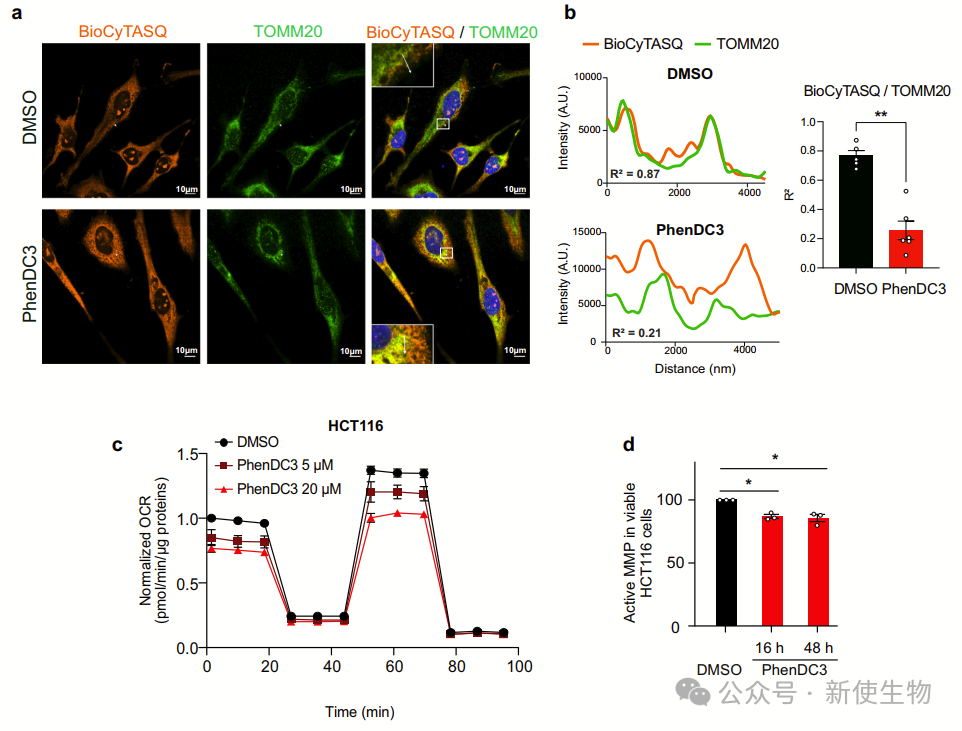
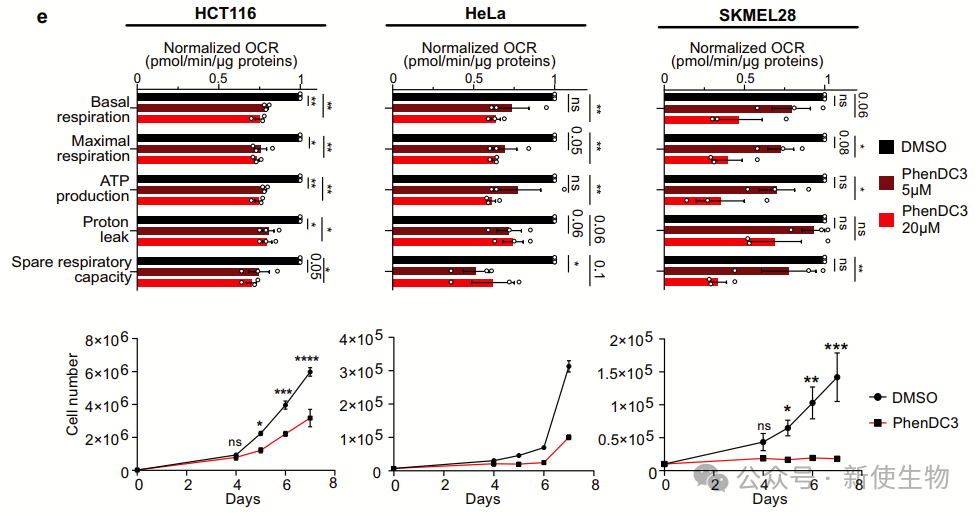
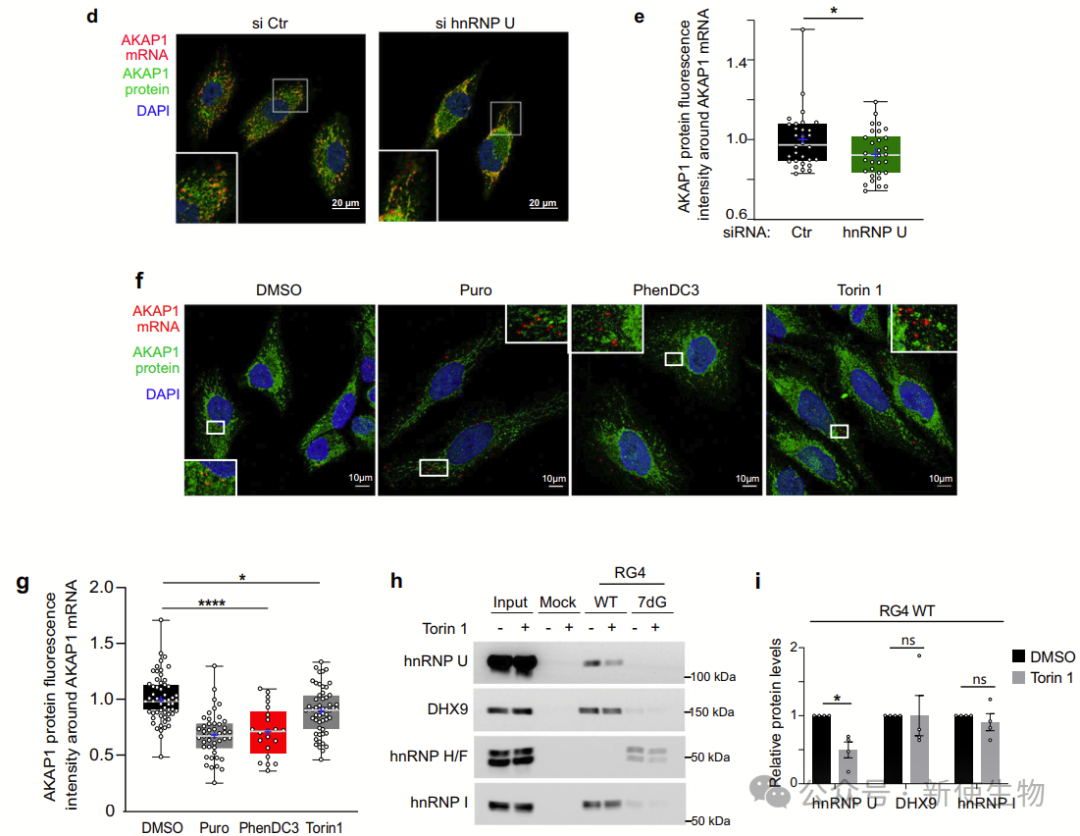
RG4结构促进核编码线粒体mRNA在线粒体外膜(OMM)处的局部翻译。RG4稳定化(如PhenDC3处理)会削弱其与线粒体的共定位,抑制翻译。
突变RG4或阻断其形成同样降低翻译效率,表明RG4是OMM定位翻译的重要顺式元件,其动态变化对线粒体功能调控至关重要。
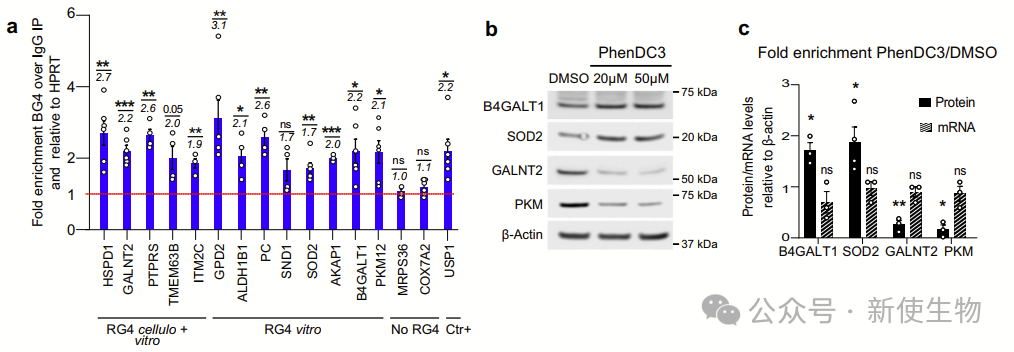
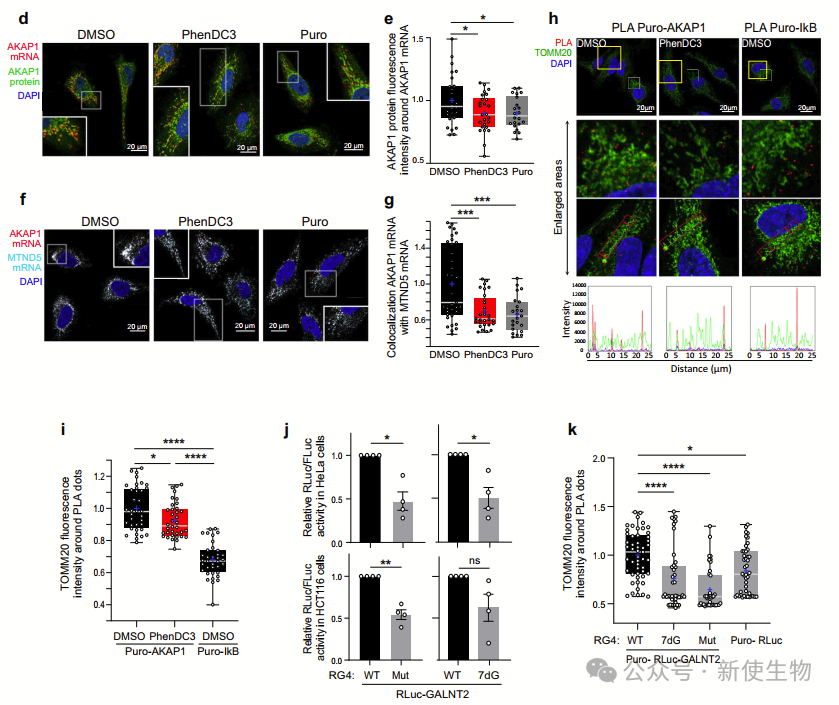
研究者发现hnRNP U结合RG4,特别是核编码的线粒体mRNA,影响其结构平衡。
hnRNP U富集于细胞质,能优先结合RG4序列,且与代谢重编程通路相关。其可能通过与解旋酶合作,促进RG4解开,调控mRNA的翻译。
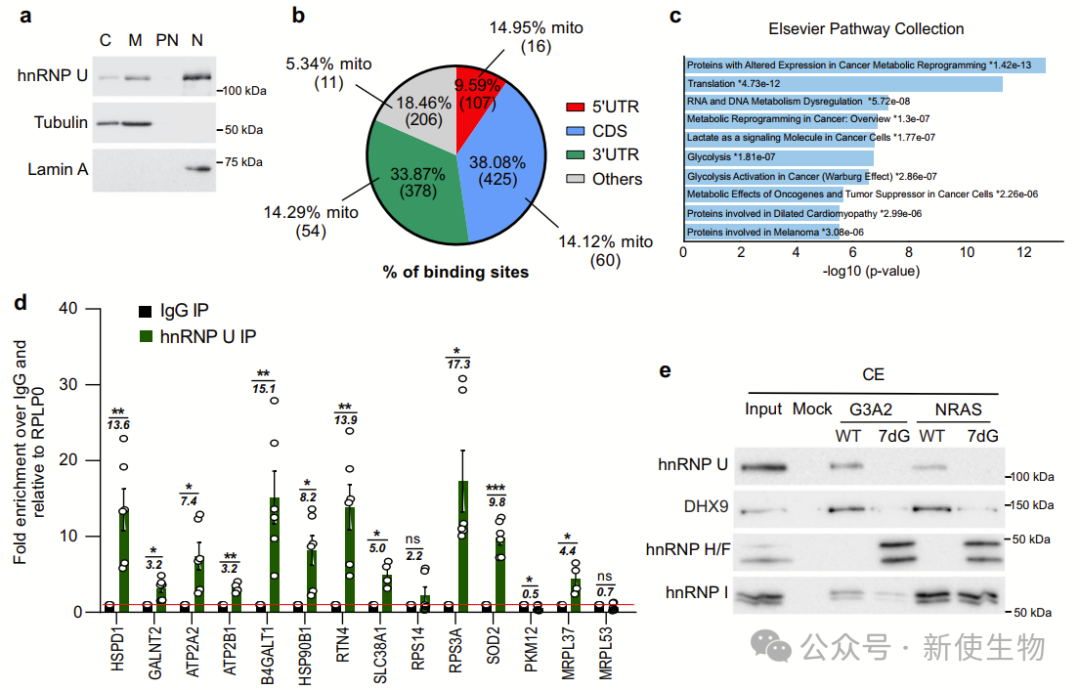
四. hnRNP U定位于外线粒体膜并与翻译机械和核编码线粒体蛋白相互作用
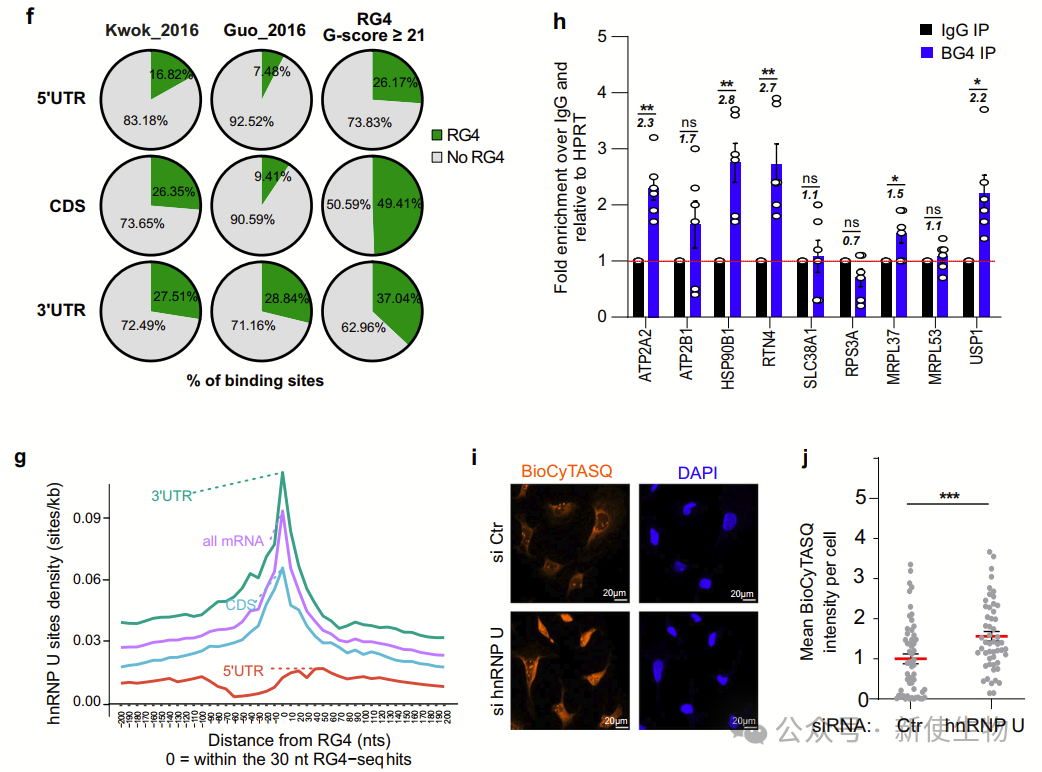
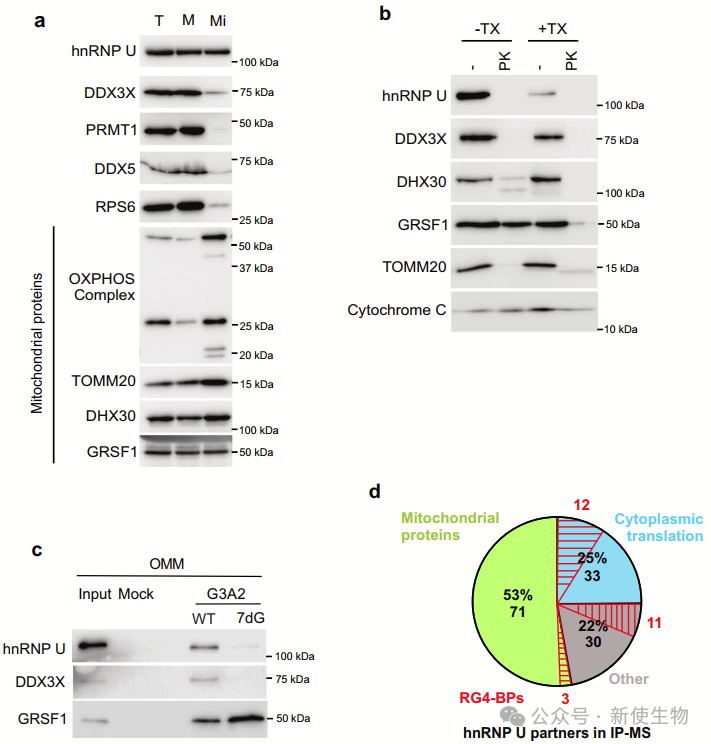
hnRNP U定位于外线粒体膜(OMM),与核编码线粒体mRNA、翻译元件(如核糖体、RG4结合蛋白和解旋酶DDX3X)以及线粒体蛋白相互作用。
作者通过纯化线粒体和RNA拉下实验,发现hnRNP U优先与折叠的RG4结合,分析揭示它与翻译和线粒体翻译相关的蛋白质互作。
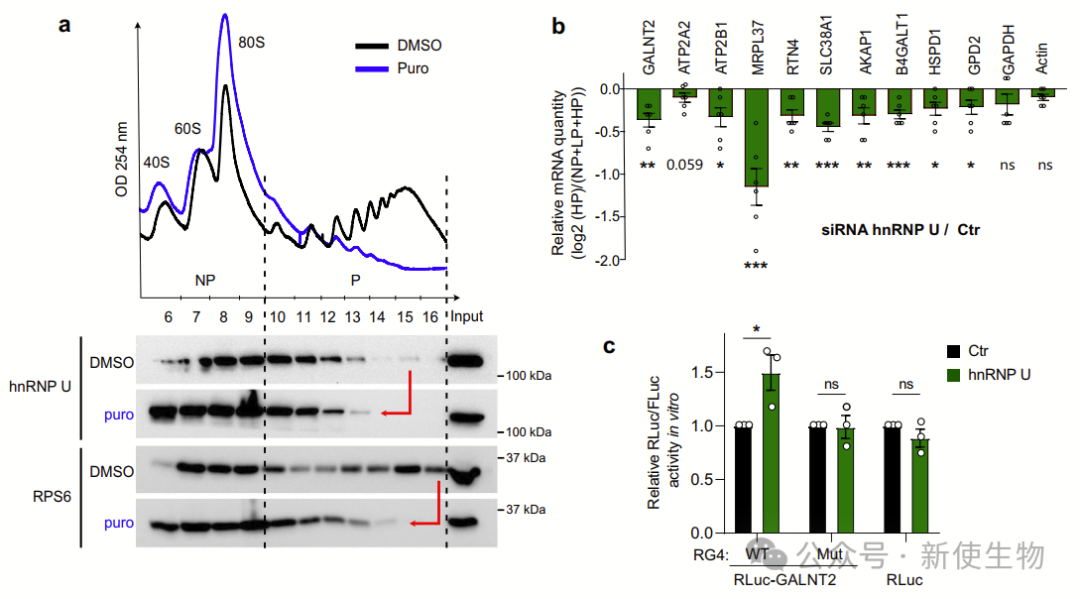
五. hnRNP U调控RG4含量mRNA靶标在外线粒体膜(OMM)上的蛋白质合成
研究发现,Polysome profiling多聚核糖体分析显示hnRNP U通过与多聚核糖体的结合,调控含RG4的核编码线粒体mRNA的翻译。hnRNP U的去除选择性地抑制了这些mRNA的翻译,而整体蛋白质合成未受影响。
mTOR通路通过调节RG4结构和hnRNP U的磷酸化,进一步调控这一翻译过程。这揭示了mTOR-hnRNP U-线粒体翻译轴,调控细胞的能量生产。
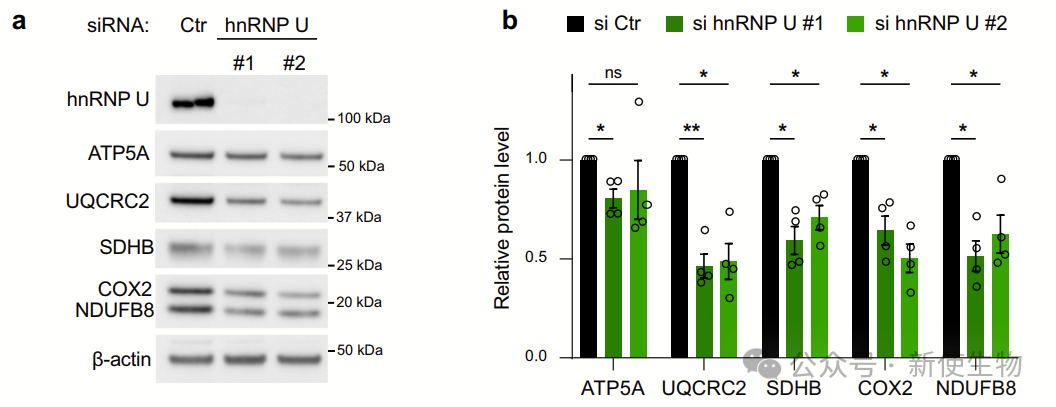
六. hnRNP U通过调控OXPHOS复合物蛋白的合成影响氧化代谢
hnRNP U沉默降低OXPHOS复合物表达,抑制线粒体呼吸和ATP生成,并减少糖酵解。
DDX3X和hnRNP U沉默共同减少这些代谢功能,恢复hnRNP U表达可恢复代谢功能。RG4稳定化也抑制OXPHOS和糖酵解,表明hnRNP U调节氧化代谢与糖酵解的平衡。

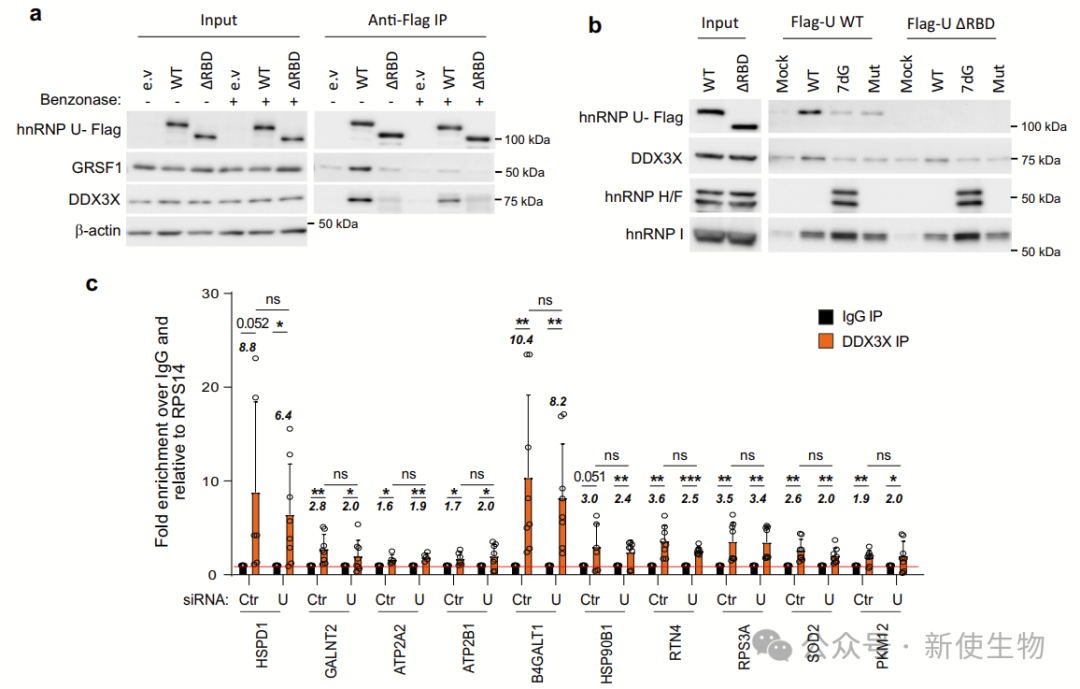
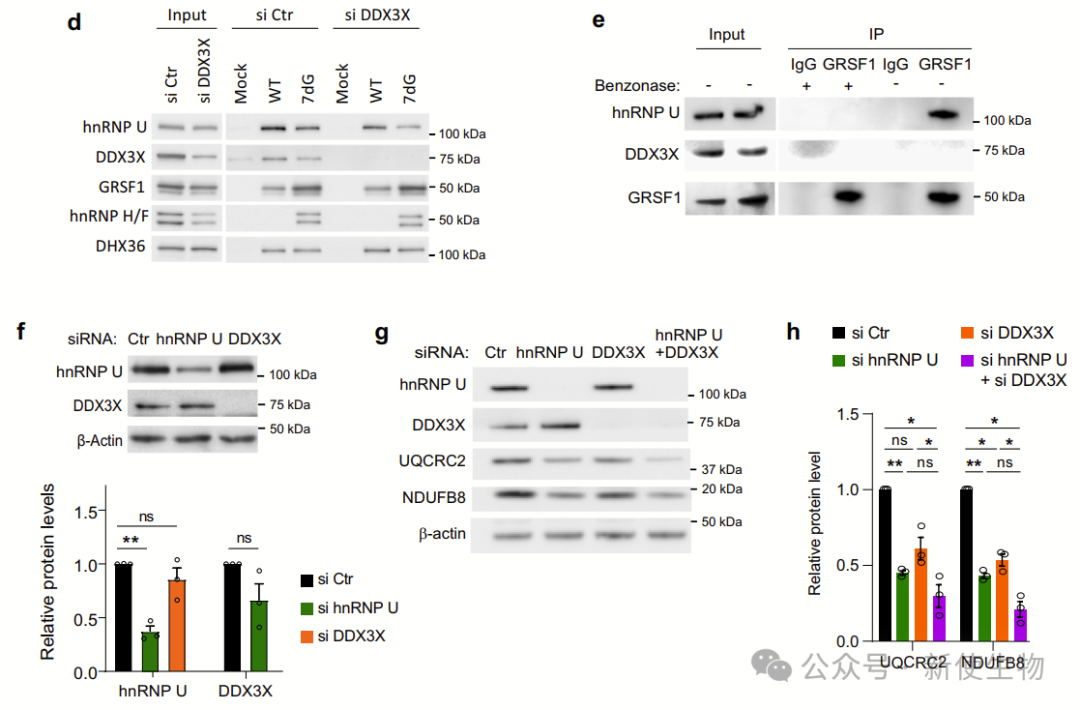
七. hnRNP U、DDX3X和GRSF1在转录调控中协同作用,调节RG4含量的核编码线粒体mRNA的翻译
研究表明,hnRNP U、DDX3X和GRSF1共同参与调控RG4含量的核编码线粒体mRNA的翻译。它们通过互相作用,协同维持RG4结构未折叠状态,从而影响线粒体功能和能量代谢。
hnRNP U和DDX3X的相互作用并不相互调节表达,且联合沉默两者对线粒体蛋白表达的影响与单独沉默相似,支持顺序招募模型。
总结
癌细胞依赖线粒体提供能量和合成大分子,线粒体蛋白合成调控在此过程中至关重要。本文揭示RNA G-四链体(RG4s)通过调节核编码线粒体蛋白的细胞质翻译,影响线粒体功能,进而影响能量代谢和癌细胞增殖。
新使生物NeoRibo推出国内首个低起始量超高分辨率翻译组Ribo-seq服务。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
