导读
癌症基因组是由突变塑造的,这些突变改变了DNA的序列或结构,并伴随着肿瘤演化。
对单个基因反复突变的识别推动了致癌基因和肿瘤抑制基因的发现,但多基因遗传损伤(如染色体数目异常或局部拷贝数改变)在癌症中普遍存在,目前尚不清楚哪些基因驱动肿瘤演化,哪些为“乘客基因”。这种区分对癌症治疗有重要意义。
12q13-15区域的染色体扩增是常见的局部拷贝数异常,特别在分化良好和去分化脂肪肉瘤中常见。分化良好和去分化脂肪肉瘤是生物学上相关的肿瘤,去分化脂肪肉瘤源自分化良好的脂肪肉瘤,具有更侵袭性的临床行为。为了简化,研究者将两者视为同一疾病的不同变种,并统一称为“脂肪肉瘤”。
2025年1月31日,美国波士顿儿童医院血液肿瘤科Alejandro Gutierrez团队在Molecular Cell上发表了一篇题为“A methyltransferase-independent role for METTL1 in tRNA aminoacylation and oncogenic transformation”的论文,发现METTL1独立于其甲基转移酶活性,通过刺激tRNA氨酰化、蛋白质合成和肿瘤细胞生长,促进肉瘤发生。

文章索引
【发表日期】2025年1月31日
【IF】15.58
研究结果
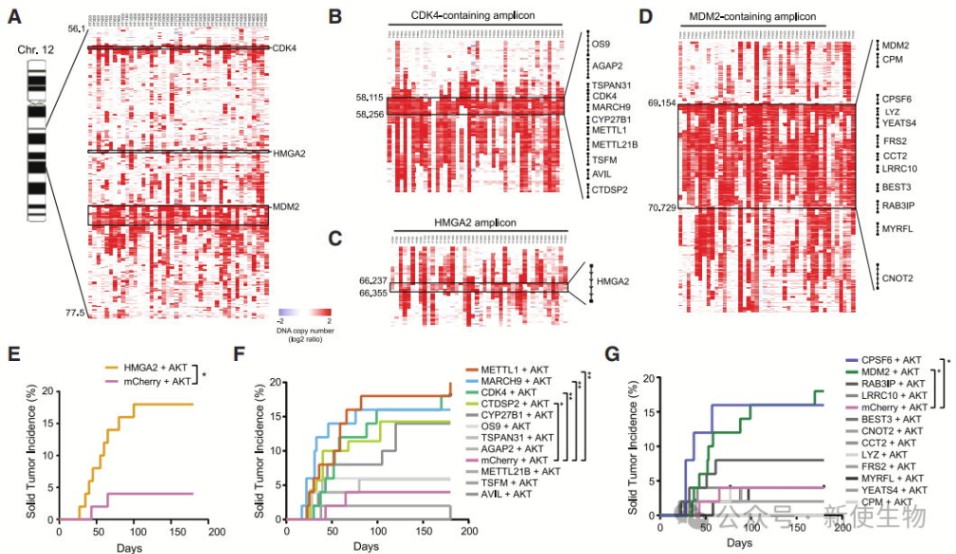
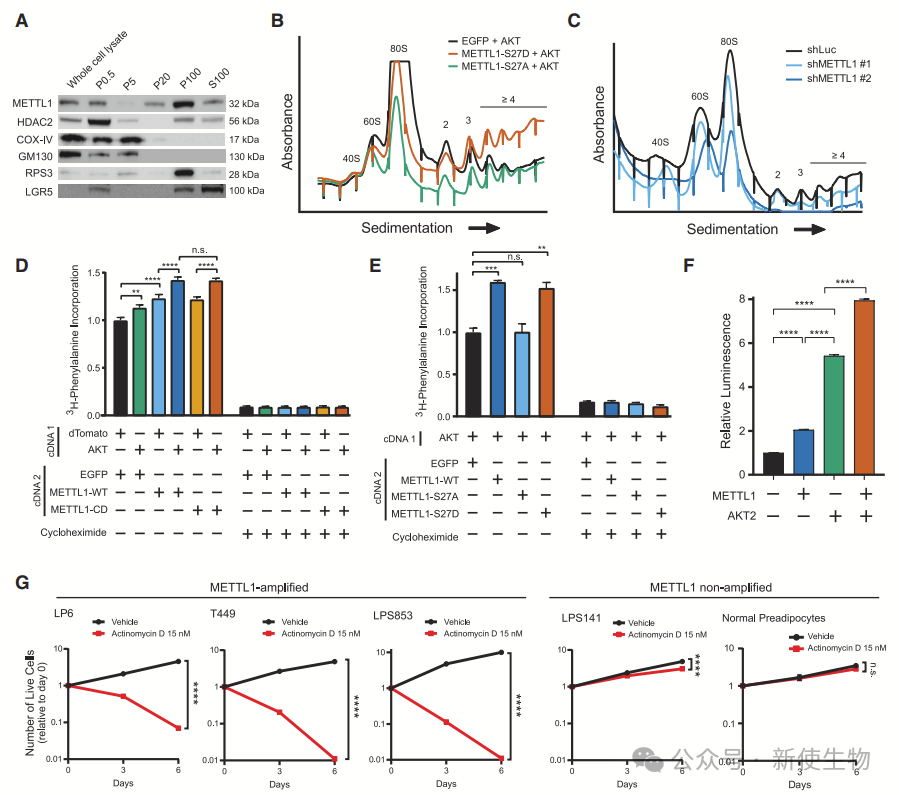
一. 12q13-15扩增区包含多个致癌基因
通过斑马鱼模型过表达12q13-15扩增区的基因,作者发现HMGA2、CDK4、METTL1和MDM2等基因与AKT协同促进脂肪肉瘤发生,验证了这些基因在肿瘤中的致癌作用。
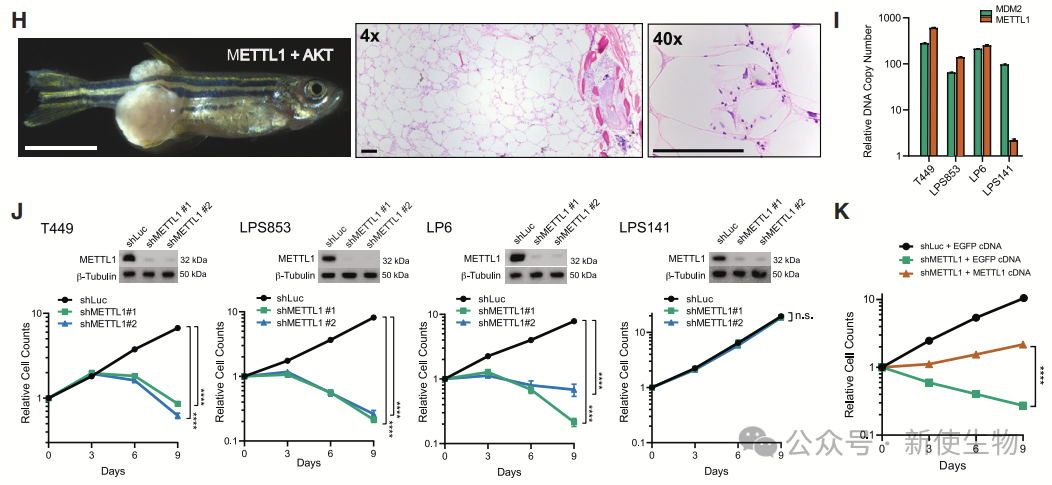
二. METTL1过表达促进肉瘤发生
作者发现METTL1在AKT驱动的脂肪肉瘤中具有致癌作用。通过METTL1基因扩增的人类脂肪肉瘤细胞实验,METTL1的敲低对高扩增细胞具有选择性毒性,验证了其在脂肪肉瘤中的致癌作用。
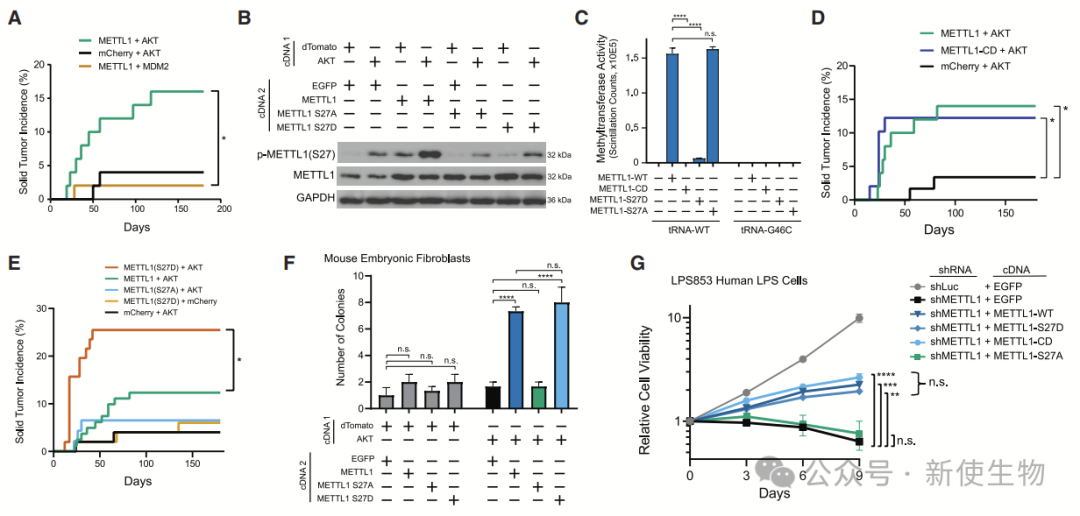
三. METTL1在肉瘤发生中的作用与甲基转移酶活性无关
METTL1与AKT协同作用促进肉瘤发生,且其在肿瘤中的作用与甲基转移酶活性无关。
尽管AKT抑制METTL1的甲基转移酶活性,但失活的METTL1突变体仍具有致癌性,而非磷酸化突变体则失去致癌性。
四. METTL1促进多核糖体形成和蛋白质合成
METTL1在脂肪肉瘤细胞中主要集中于粗核糖体组分,可能通过非甲基转移酶活性调控核糖体功能。
Polysome profiling多聚核糖体分析显示其过表达与AKT共同作用,促进多聚核糖体形成和蛋白质合成。
METTL1突变体S27D增强翻译活性,而S27A突变体未能增强。METTL1扩增的肿瘤细胞对低剂量的放线菌素D表现出更高的敏感性,提示其对抑制核糖体生物合成的药物更为敏感。
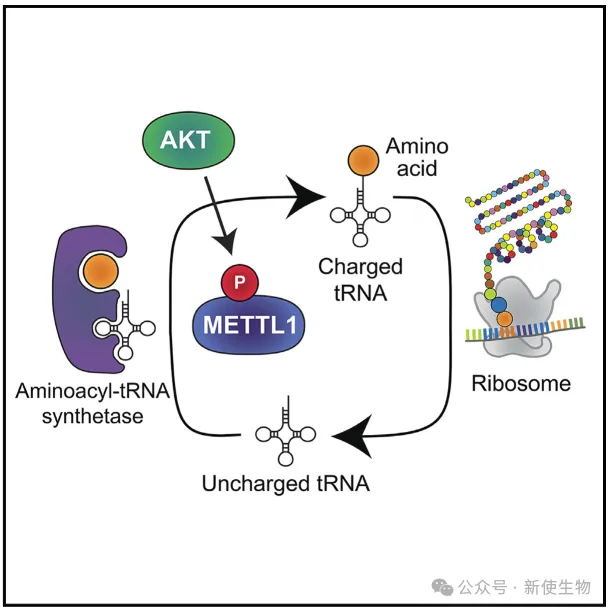
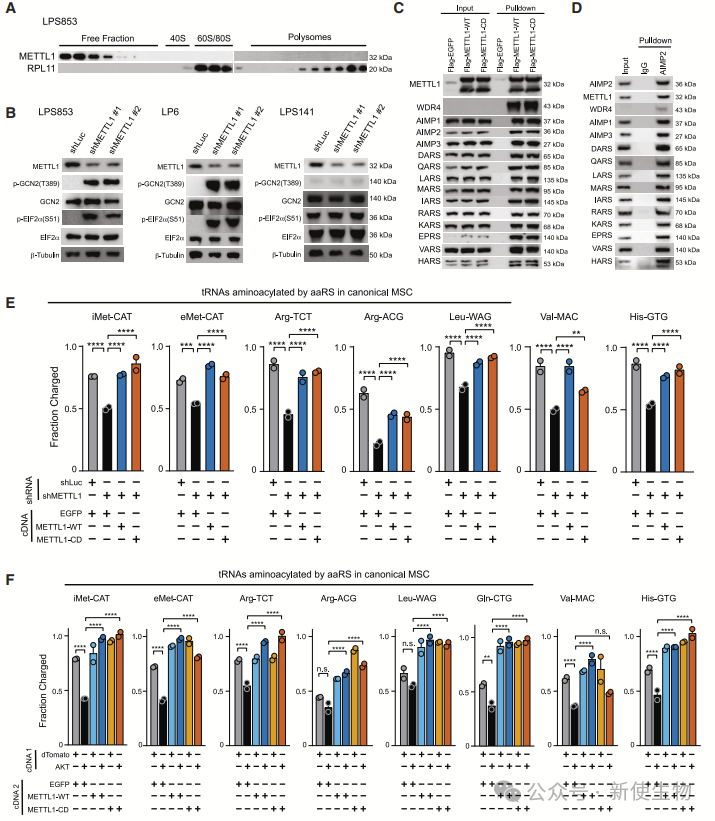
五. METTL1结合多tRNA合成酶复合物并调控tRNA氨酰化
为了研究METTL1如何调控翻译,作者发现METTL1不直接与核糖体复合物结合,而是通过调节tRNA氨酰化来影响翻译。
METTL1通过与多tRNA合成酶复合物(MSC)结合,促进tRNA氨酰化,进而刺激蛋白质合成,促进肿瘤细胞生长。
进一步的研究显示,METTL1过表达能够增加tRNA氨酰化,且这一效应不依赖于其甲基化活性。此外,作者使用Ribo-seq核糖体印迹分析表明,METTL1通过调节全局tRNA氨酰化影响蛋白质合成,而非选择性地调控特定转录本的翻译效率。
这表明METTL1通过促进tRNA氨酰化,缓解翻译中的限制,推动肿瘤发展。
总结
本文发现METTL1基因在脂肪肉瘤中的扩增与AKT协同促进肿瘤发生。METTL1通过结合多tRNA合成酶复合物,促进tRNA氨酰化、聚糖体形成和蛋白质合成,且不依赖其甲基转移酶活性。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们
